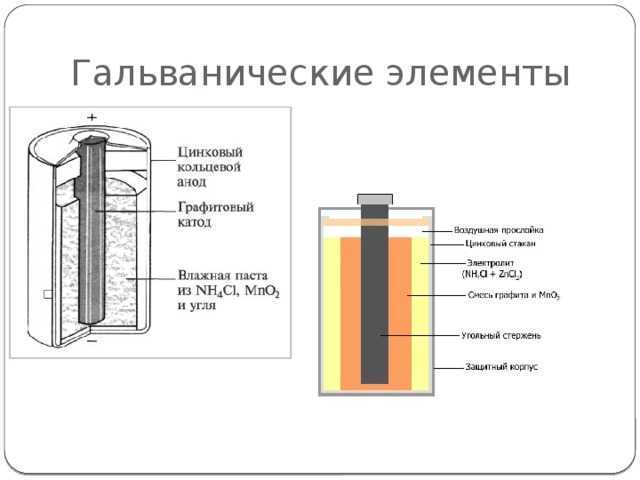
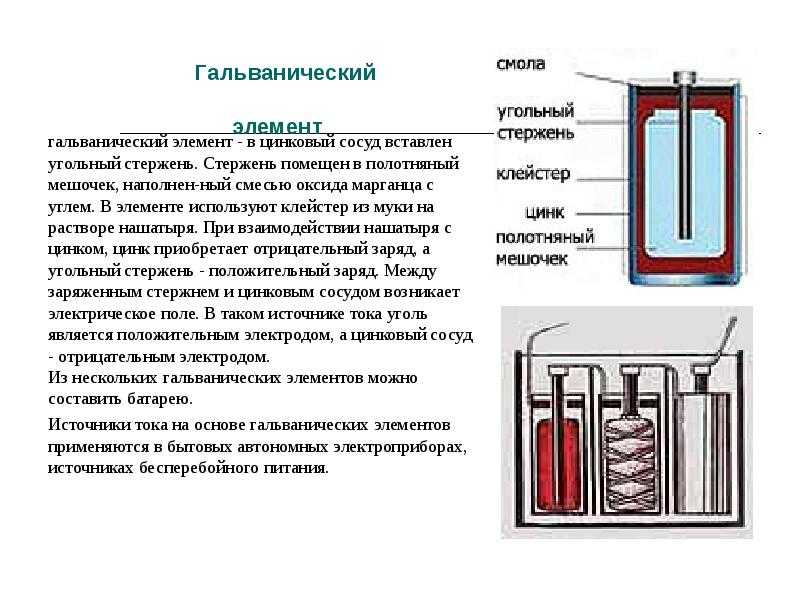
Литиевая батарейка
Литий-марганцевая диоксид батарейка -это относительно недавняя разработка, использующая преимущества высокого электродного потенциала и плотности энергии металлического лития. Она предлагает значительно большую плотность энергии и емкость, чем “щелочная” и угольная, при относительно небольшом увеличении стоимости.
Литий находится в форме очень тонкой фольги и запрессован внутри банки из нержавеющей стали, чтобы сформировать отрицательный электрод.
Положительный электрод — диоксид марганца, смешанный с углеродом для улучшения его проводимости, а электролит-перхлорат лития растворен в пропиленкарбонате.
Номинальное напряжение на клеммах литиевого элемента составляет 3,0 в, что в два раза больше, чем у “щелочных” и других гальванических элементов. Он также имеет очень низкую скорость саморазряда, что дает ему очень длительный срок хранения. Внутреннее сопротивление также довольно низкое и остается таким в течение всего срока службы.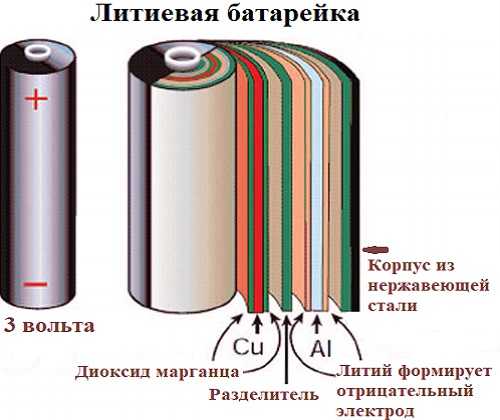
Литиевая батарея хорошо работает при низких температурах, даже ниже -60 °C, и передовые разработки используют их в спутниках связи, космических аппаратах, военных и медицинских приложениях. Медицинские приложения, требующие длительного срока службы критически важных устройств, таких как искусственные кардиостимуляторы и другие имплантируемые электронные медицинские устройства, используют специализированные литий-ионные батареи, которые могут работать в течение многих лет.
Литиевые гальванические элементы батарейки подходят для менее важных применений для работы с игрушками, часами и камерами. Хотя литиевые батареи стоят дороже, они обеспечивают более длительный срок службы, чем «щелочные» батареи, и сводят к минимуму их замену.
На практике, однако, напряжение на клеммах уменьшается по мере уменьшения заряда. Именно по этой причине, в отличие от вторичных батарей, первичные, как правило, не получают спецификации емкости ни в ампер-часах, ни в миллиампер-часах от большинства производителей вместо этого обычно задается только максимальный ток разряда.
Литиевые гальванические элементы обладают значительно большей плотностью энергии и емкостью, чем “щелочные” и другие первичные батареи; они обеспечивают более высокое (примерно в два раза) напряжение на клеммах по сравнению с другими первичными элементами, и напряжение на клеммах остается почти постоянным в течение всего срока службы.
Принцип работы
Литиевая батарея известна как «электронный насос» из-за носителей заряда, перемещающихся между двумя электродами во время зарядки и разрядки. Электрическое (насосное) давление или разность потенциалов между положительной и отрицательной клеммами называется напряжением или электродвижущей силой (ЭДС). Свободная энергия, связанная с переносом электронов вокруг внешней цепи и ионов лития между двумя интеркалирующими электродами, связана с разницей в химическом потенциале лития в двух электродах.
Элементы батареи накапливают энергию химически в своих электроактивных материалах. Эта химическая энергия преобразуется в электрическую энергию по требованию, посредством электрохимической реакции окисления-восстановления.
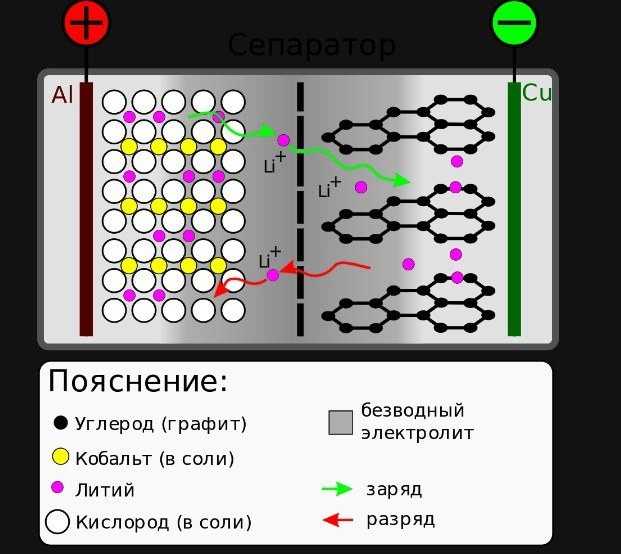
Аккумуляторная батарейка
Клетки построены в разряженном состоянии. При зарядке положительный электрод, катод, материал окисляется, ионы Li + де-интеркалируются из слоистого интеркалирующего литиевого источника, например LiCoO2, проходят через электролит.
Когда элемент разряжается, на отрицательном электроде происходит реакция окисления, ионы Li + де-интеркалируются из анода и мигрируют через электролит, чтобы быть повторно интеркалированными в материал катода. Одновременная реакция электрохимического восстановления протекает на положительном электроде и принимает электроны из внешнего контура, ионы Li + из электролита, чтобы преобразовать исходный материал. Переход от электронного тока к ионному току происходит на границе раздела электрод/электролит.
- Реакция восстановления положительного электрода (катода): Li 1 -xCoO 2 + xLi + + xe- → LiCoO2
- Реакция окисления отрицательного электрода (анода): LiC 6 → xLi + + xC6 + e-
- Общая обратимая, окислительно-восстановительная, клеточная реакция: LiC 6 + CoO 2 C6 + LiCoO 2

Применение ячеек
Гальванические элементы: преимущества и недостатки
Для изготовления современных гальванических элементов используются самые различные материалы. Наиболее распространенными являются материалы на основе угольно-цинковых элементов, используемых для пальчиковых .
Их основным положительным качеством считается относительно низкая стоимость. Однако, такие элементы обладают невысокой мощностью и небольшим сроком хранения. Наиболее оптимальным вариантом служит использование щелочных элементов. Здесь в качестве электролита выступает не уголь, а раствор щелочи. При разрядке не происходит выделение газа, что позволяет обеспечить полную герметичность. Щелочные элементы отличаются более высоким сроком хранения.
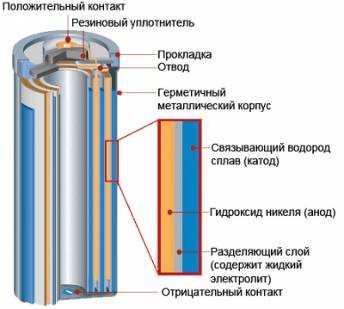
Общий принцип работы гальванического элемента для всех их видов совершенно одинаковый. Например, элементы на основе оксида ртути конструктивно напоминают щелочные. Они отличаются повышенной устойчивостью к высокой температуре, высокой механической прочностью и стабильным значением напряжения
Недостатком является токсичность ртути, требующая осторожного обращения с отработанными элементами
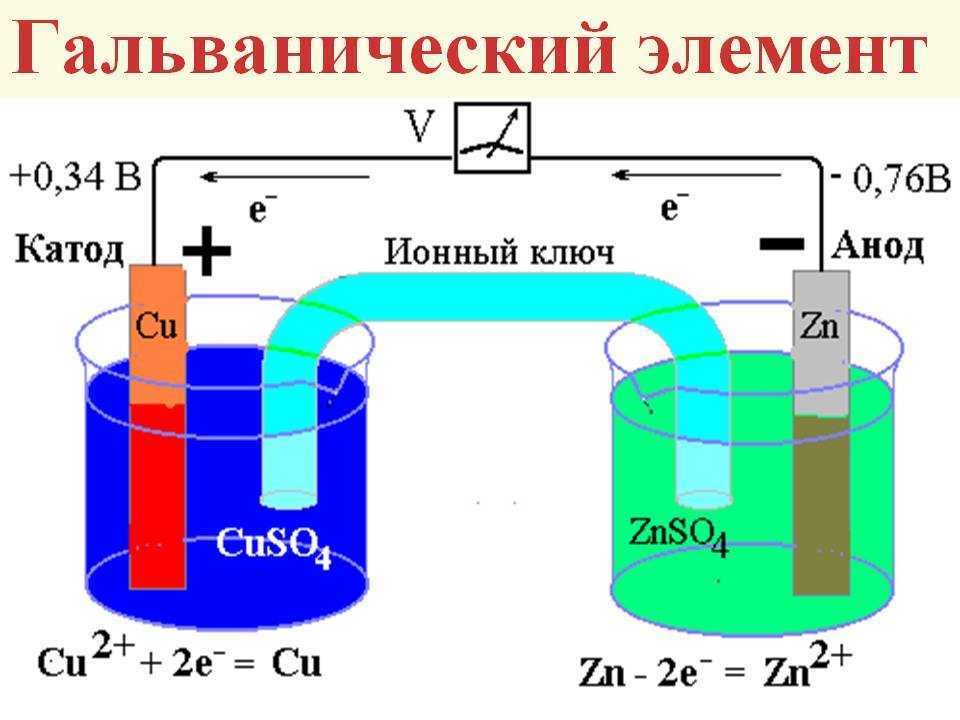
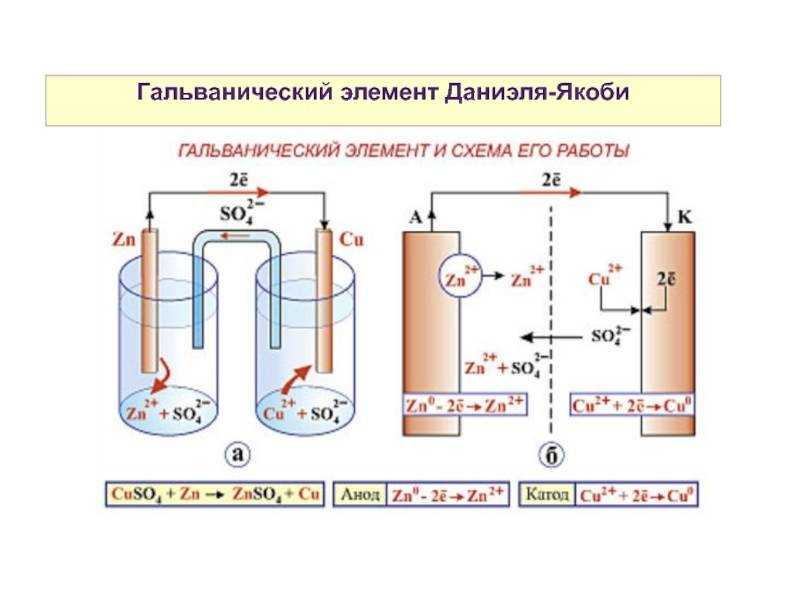
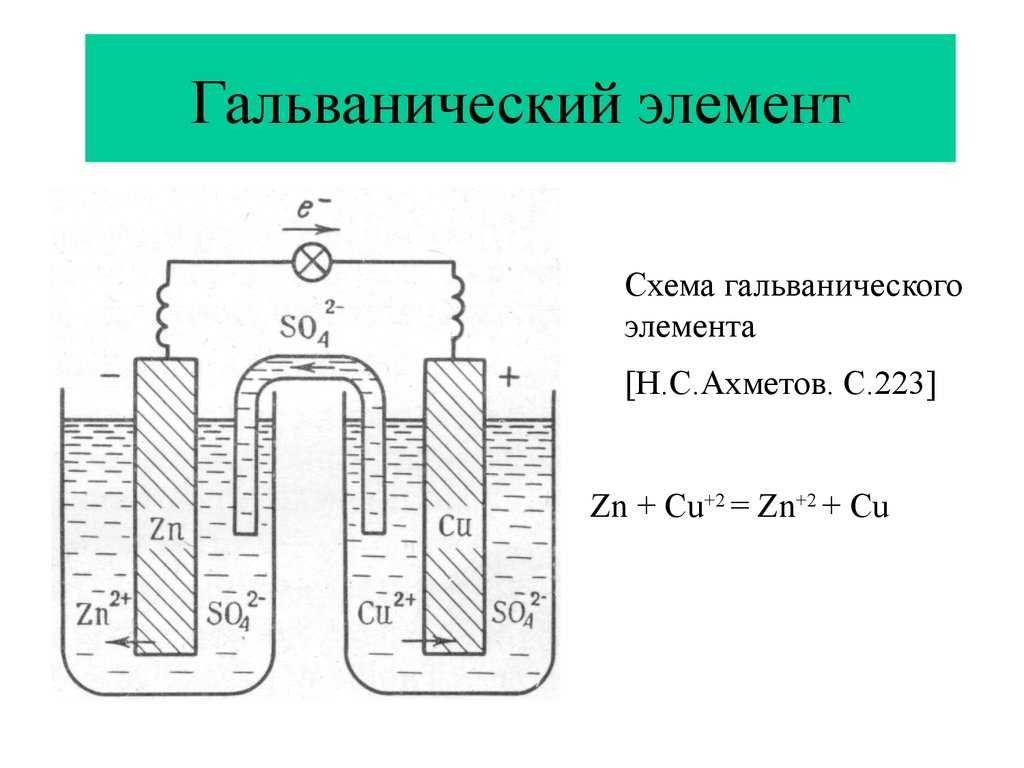
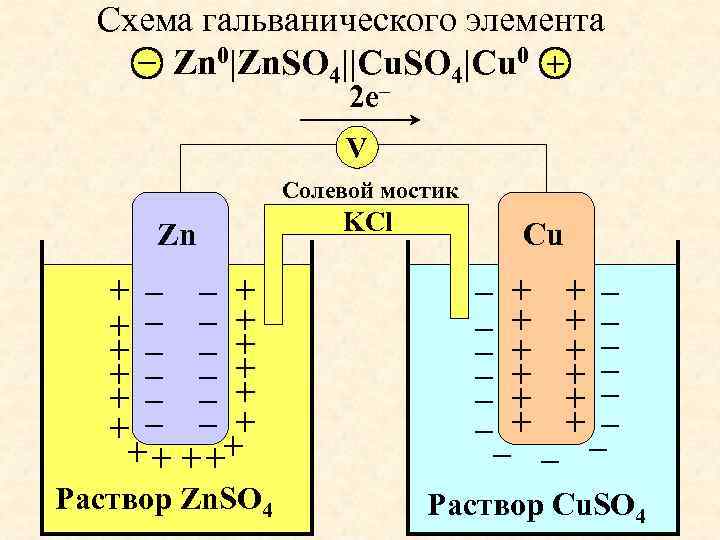
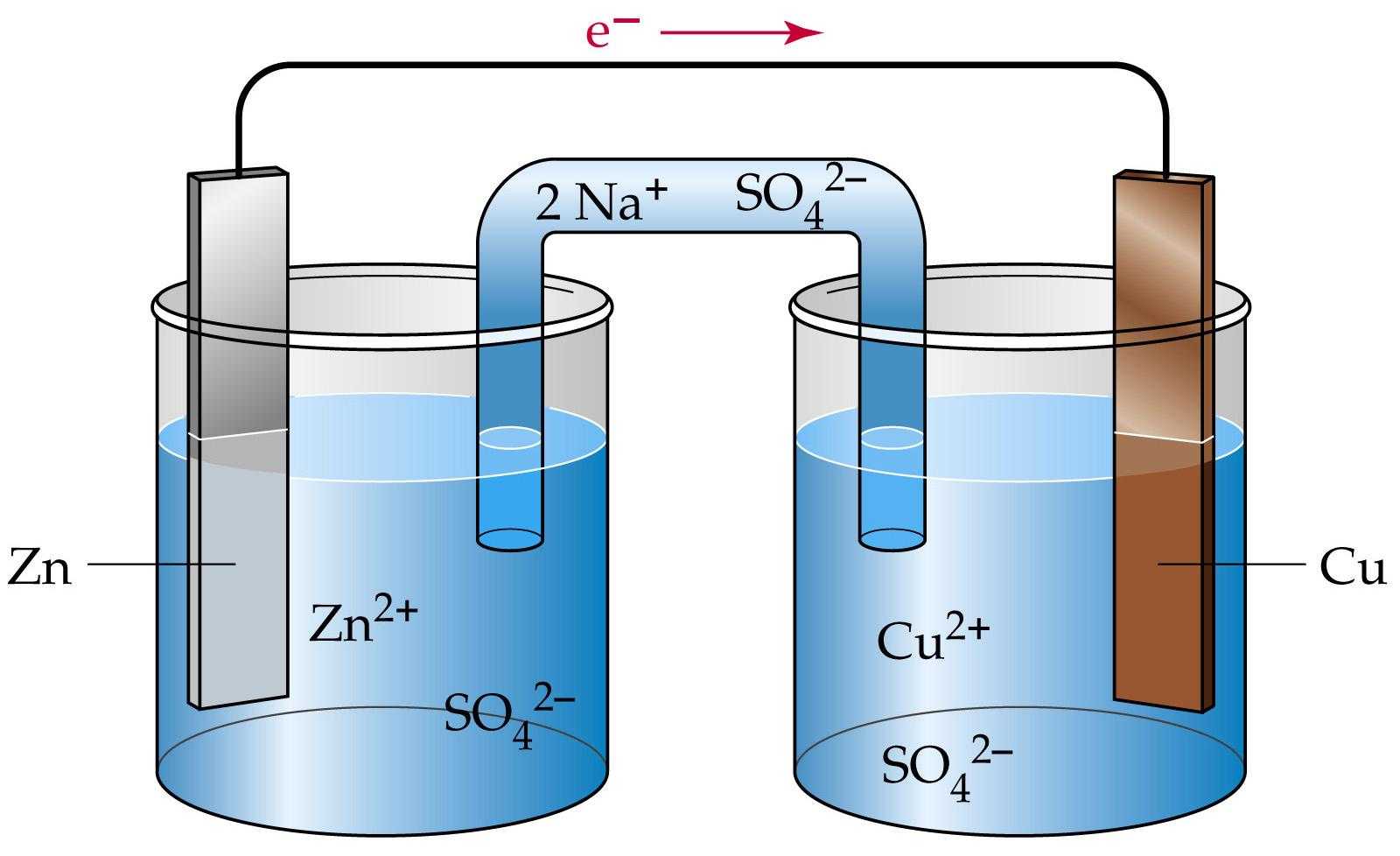
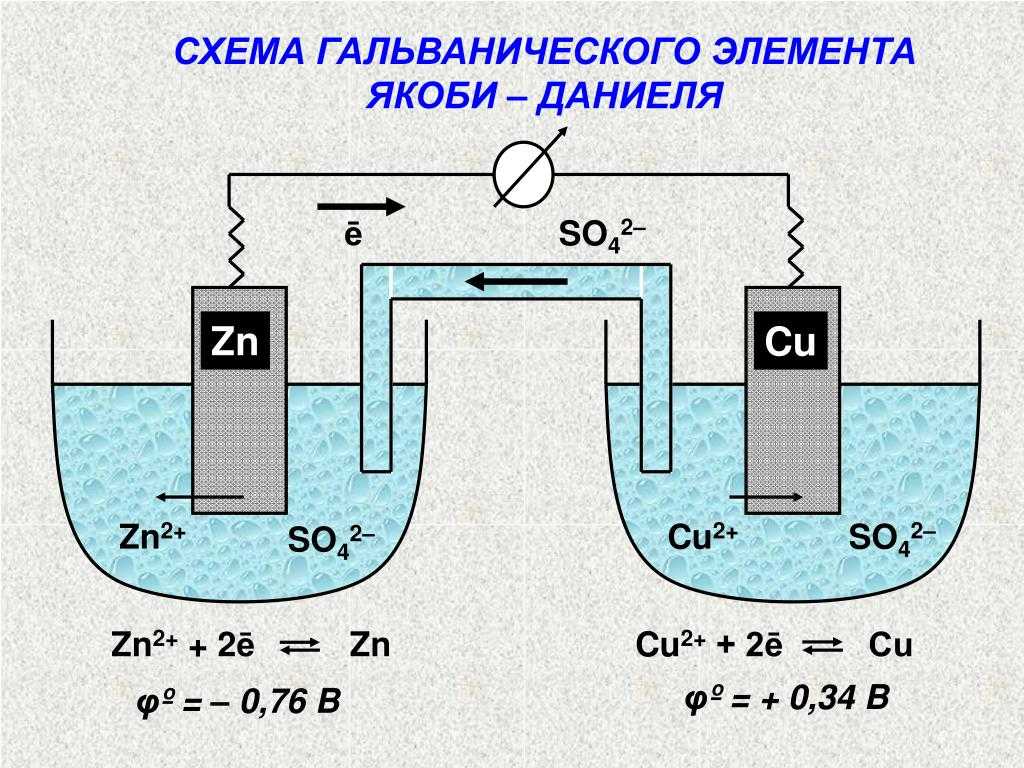
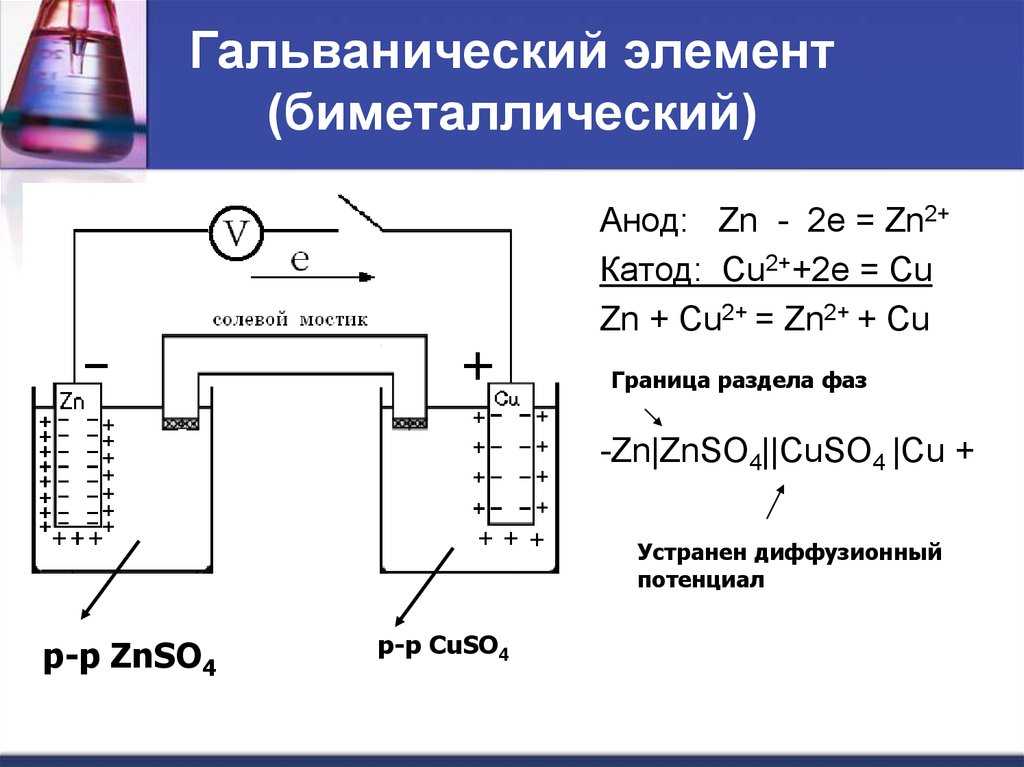
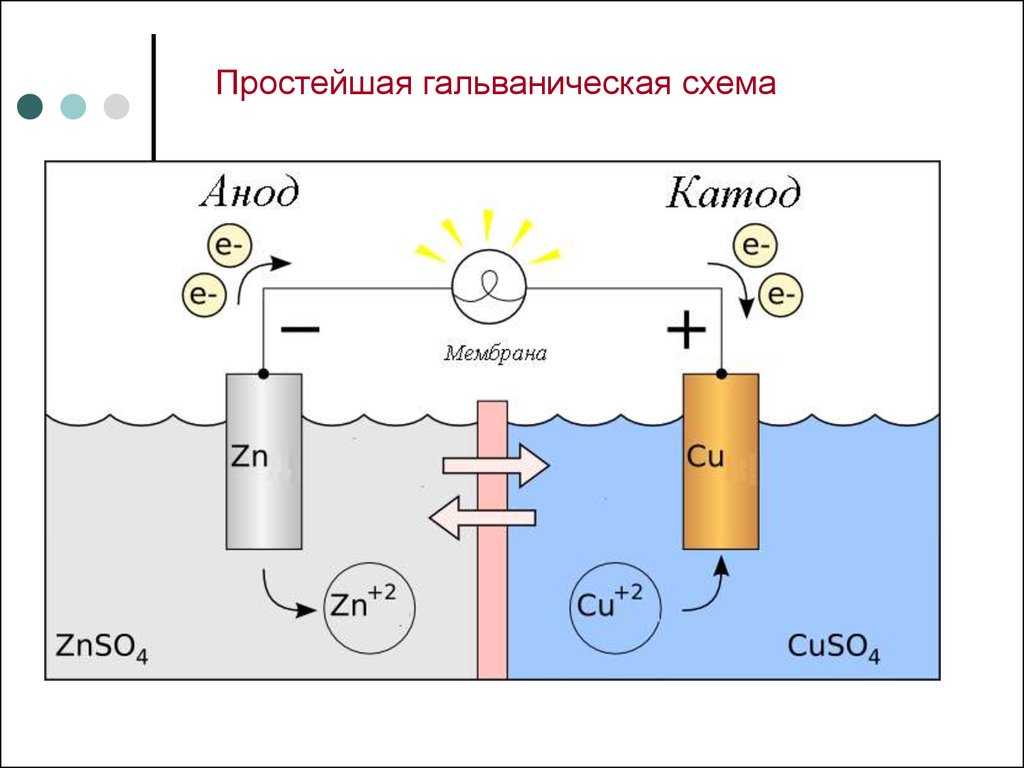
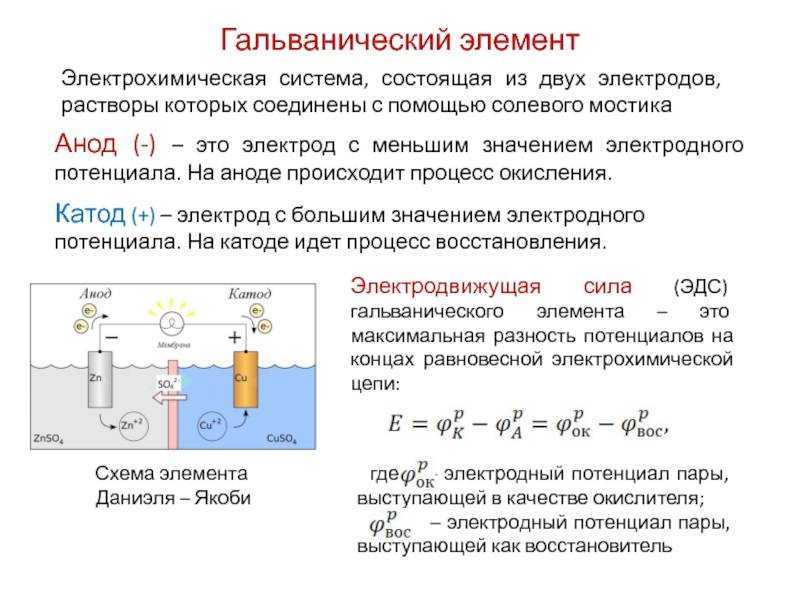
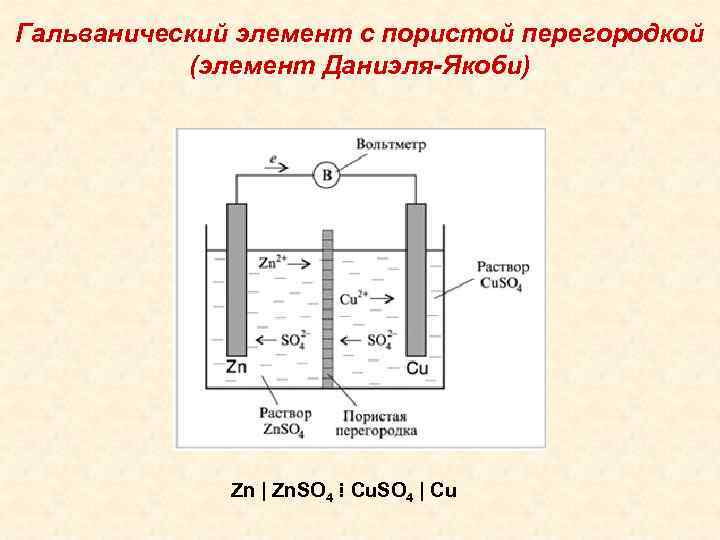
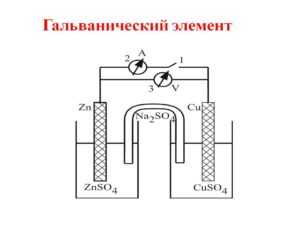
Гальванический элемент
Схема гальванического элемента Даниэля-Якоби
Гальвани́ческий элеме́нт
— , основанный на взаимодействии двух металлов и (или) их оксидов в электролите , приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани .
Явление возникновения электрического тока при контакте разных металлов было открыто итальянским физиологом , профессором медицины Болонского университета Луиджи Гальвани в 1786 году. Гальвани описал сокращения мышц задних лапок свежепрепарированной лягушки, закрепленных на медных крючках, при прикосновении стального скальпеля . Наблюдения были истолкованы первооткрывателем как проявление «животного электричества».
Электрохимические генераторы (топливные элементы)
— это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента электродые не расходуются. Восстановителем является водород (H 2), метанол (CH 3 OH), метан (CH 4) в жидком или газообразном состоянии. Окислителем обычно является кислород воздуха или чистый. В кислородно-водородном топливном элементе со щелочным электролитом происходит превращение химической энергии в электрическую. Энергоустановки применяются на космических кораблях, они обеспечивают энергией космический корабль и космонавтов.
Источник токов
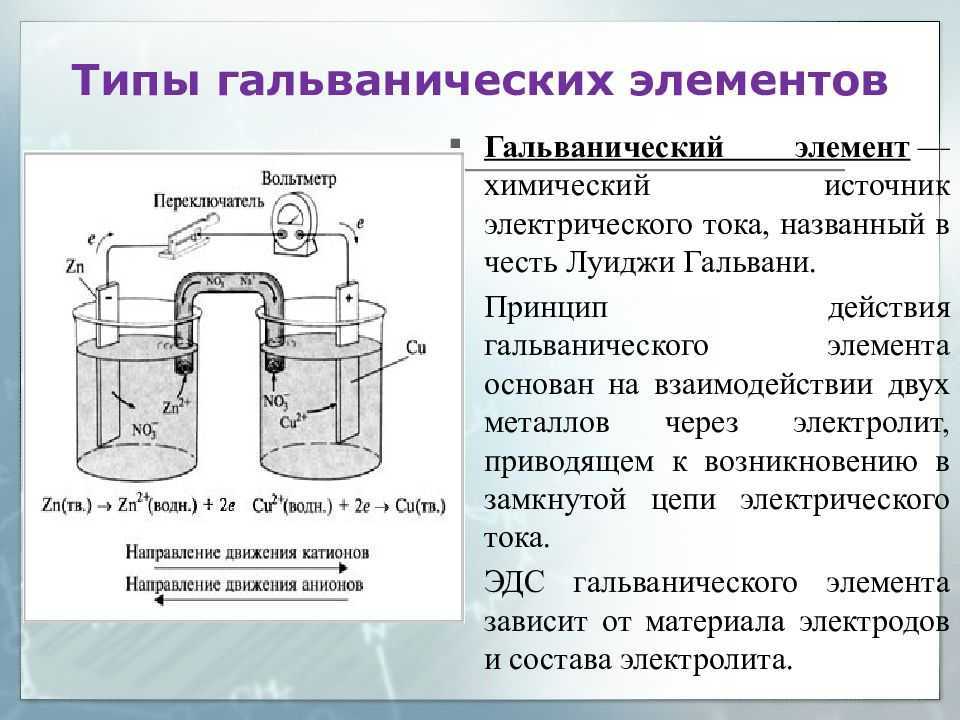
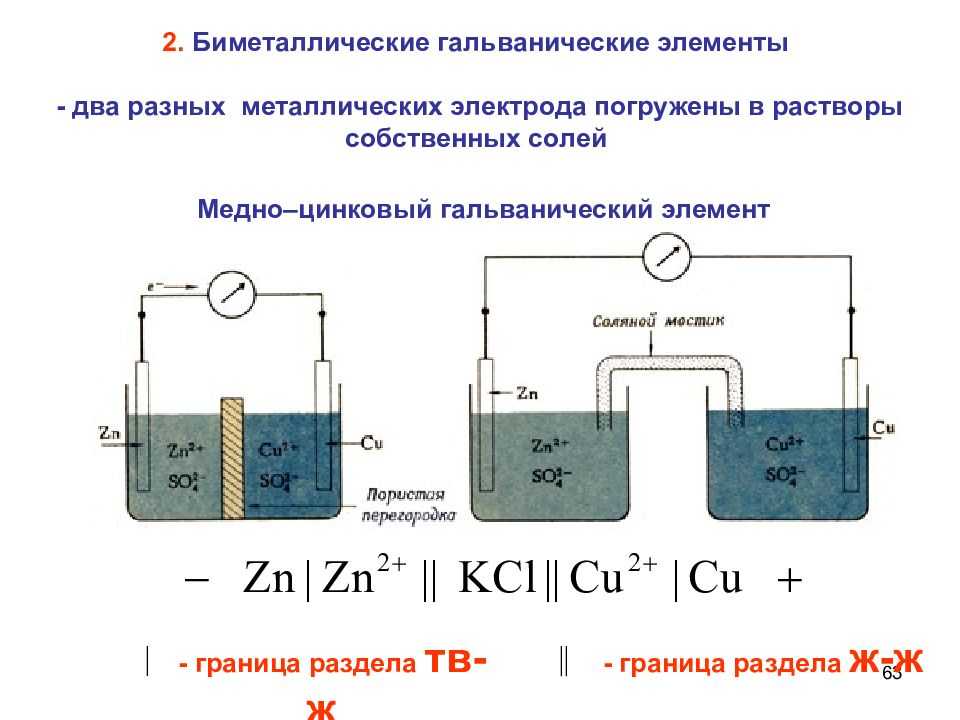
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.
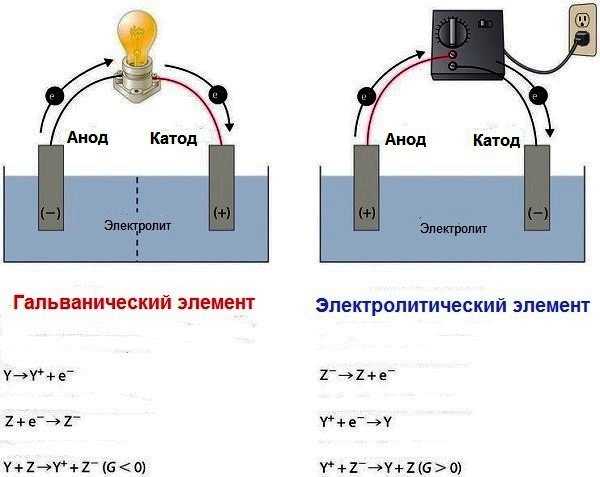
Два типа ячеек
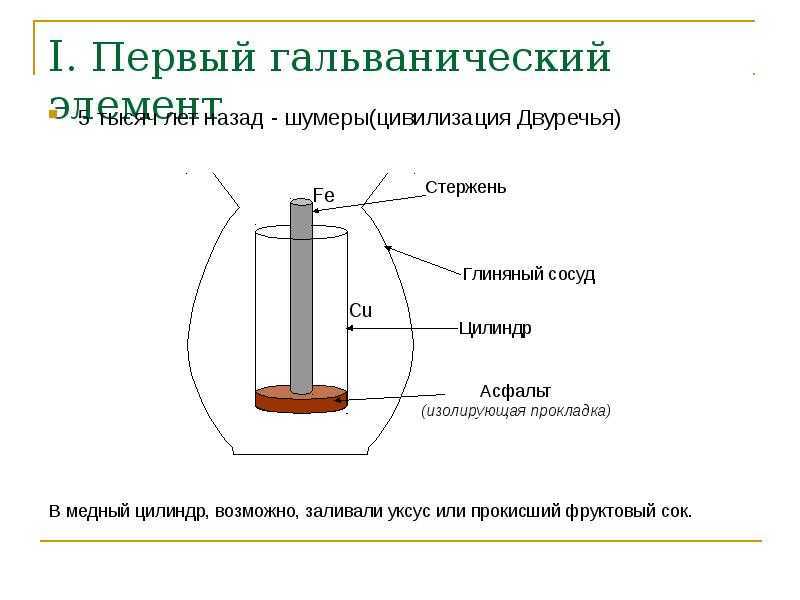
Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».

Александро Вольт
В 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
Вам это будет интересно Розетка с таймером: инструкция по применению и принцип работы
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник , представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Химические источники электрического тока
Химические источники тока – это устройства, работа которых обусловлена преобразованием выделяемой при окислительно-восстановительном процессе химической энергии в энергию электрическую.
К преимуществам химических источников тока относится универсальность их применения.
Источником питания многих бытовых устройств, а также приборов, используемых в научных лабораториях или на производстве, являются именно химические источники питания.
Востребованность химических источников тока в обеспечении функционирования аппаратуры связи или портативной электронной аппаратуры заслуживает особого внимания, так как в этом случае они являются незаменимыми.

Химические источники электротока
Конструктивно химические источники тока представляют собой два металлических электрода, разделенных электролитом. Электроды изготавливаются из металла, который является проводником электронов (электронная проводимость), а электролит изготавливается из жидкого или твердого вещества, являющегося проводником ионов (ионная проводимость).
Если для питания, какого либо потребителя, требуется высокое напряжение, то электрические аккумуляторы соединяются последовательно. В случае, когда для электропитания требуется большой ток, электрические аккумуляторы соединяются параллельно и носят название аккумуляторной батареи.
Советуем изучить Экспертиза электрооборудования: профессиональный подход к важнейшему вопросу
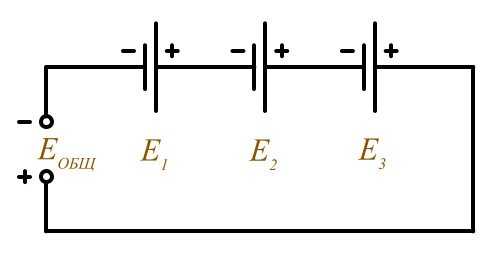
Последовательное соединение (согласное включение)
Еобщ = Е1 + Е2 + Е3
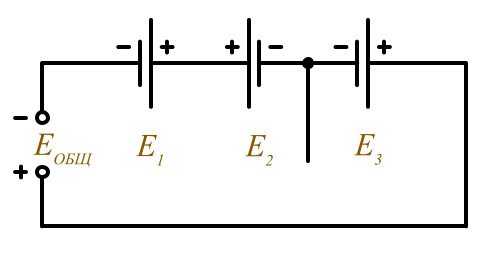
Смешанное соединение (встречное)
Еобщ = Е1 – Е2 + Е3
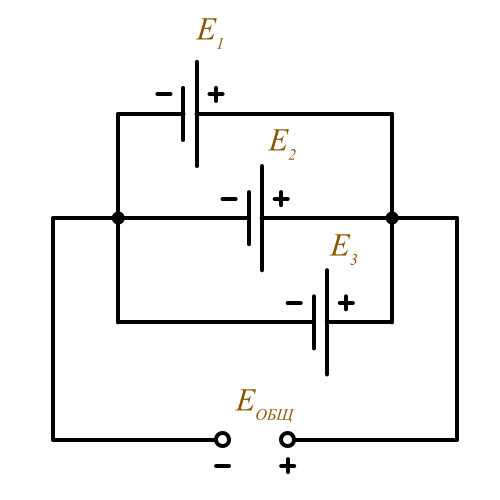
- Параллельное соединение источников питания. ( Такое соединение применяется
- для увеличения тока в цепи. )
Еобщ = Е1 = Е2 = Е3
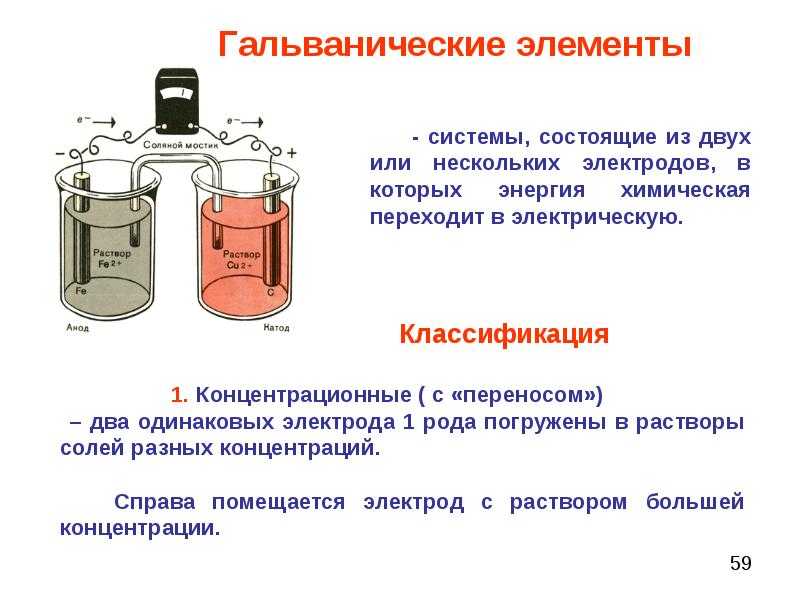
В зависимости от характера работы различные типы химических источников питания носят название гальванических элементов либо электрических аккумуляторов.
К отличительной особенности химических источников тока, называемых гальваническими элементами, относится возможность одноразового применения, так как их выделяющие электрическую энергию активные вещества подлежат полному распаду в процессе химической реакции. При полном разряде гальванического элемента его дальнейшее применение невозможно.
Особенностью таких химических источников тока, как электрические аккумуляторы, является их многоразовое использование за счет обратимости основных действующих процессов.
Разряженный электрический аккумулятор обладает способностью регенерировать свои дающие электрическую энергию активные вещества за счет процесса пропускания через него постоянного тока, источником которого служит другое устройство.
При заряде электрического аккумулятора постоянный тока другого источника должен протекать в направлении, противоположном разрядному току. Такое условие способствует замене реакции окисления на реакцию восстановления на положительном электроде, и наоборот, на отрицательном электроде реакция окисления заменяется на реакцию восстановления.
К химическим источникам тока предъявляется ряд общих и специальных технических требований. Все требования оговорены в соответствующей нормативной документации.
Общими являются требования: к габаритно-массовым характеристикам; к надежности; к отсутствию вредного влияния на окружающую среду; к безопасному использованию обслуживающим персоналом; к сроку службы; к минимальному саморазряду.
Специальными техническими условиями являются требования к удельным характеристикам, к механической прочности, к температурному диапазону рабочего режима, к невысокому значению внутреннего сопротивления, к работоспособности в любом положении, к удобству в эксплуатации.
Немного истории создания ХИТ
Ещё в восемнадцатом веке итальянский учёный Луиджи Гальвани придумал простейший элемент который химическим способом выделял электрический ток. Однако он был не только учёным, но и физиком, врачом, физиологом. Он интересовался и проводил опыты которые были направлены на изучение реакции животных на внешние раздражители. Как и всё гениальное первый химический источник энергии был получен Луиджи абсолютно случайно, во время многочисленных экспериментов над лягушками. После присоединения двух пластин из металла к лягушачьей мышце на лапке, было замечено мускульное сокращение. Гальвани посчитал это нервной реакцией на внешний раздражитель и изложил это в результатах своих исследований, попавших в руки другого великого учёного Алессандро Вольта. Он и выложил свою теорию о возникновении напряжения в результате химической реакции, возникшей между двумя металлическими пластинами в среде мускульной ткани лягушки.
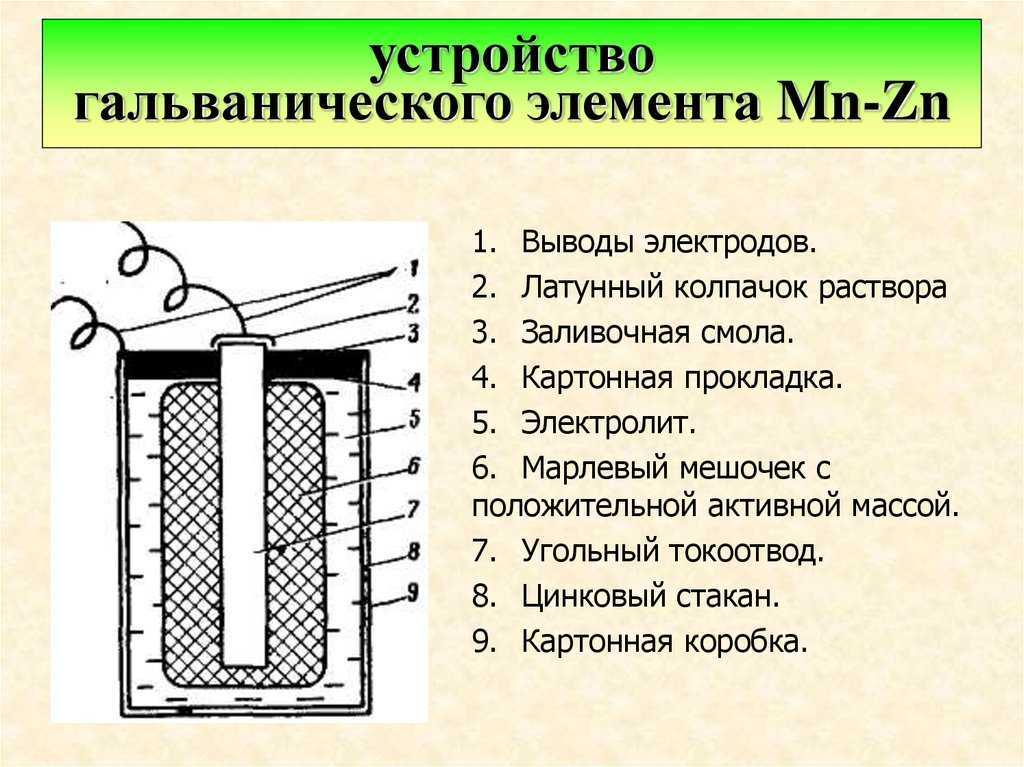
Первый химический источник электрического тока представлял собой емкость с соляным составом, в который было погружено две пластины из разных материалов. Одна из меди, другая из цинка. Именно это устройство в будущем, а конкретнее во второй половине девятнадцатого века, было применено при изобретении и создании марганцево-цинкового элемента внутри которого был тот же солевой электролит.
Общая информация
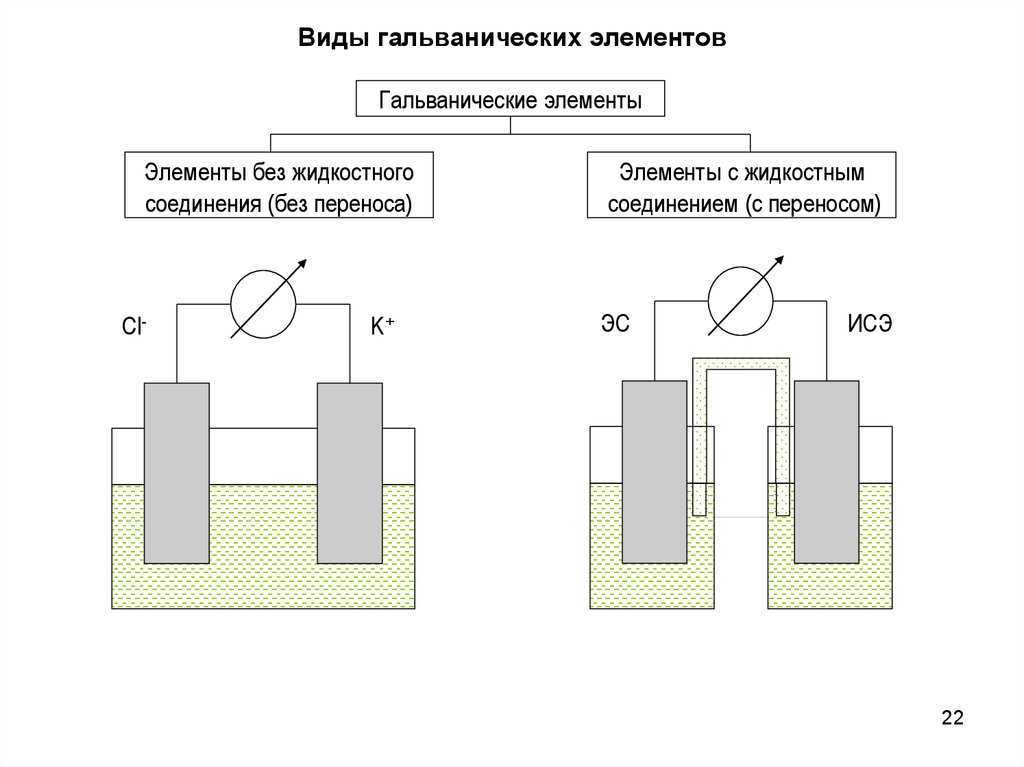
Гальванические элементы делятся на первичные и вторичные в соответствии со способностью вырабатывать электрический ток. Оба вида считаются источниками и служат для различных целей. Первые вырабатывают ток в ходе химической реакции, вторые функционируют исключительно после зарядки. Ниже обсудим обе разновидности. По количеству жидкостей различают две группы гальванических элементов:
-
Ярким примером приборов с единственной жидкостью считаются вольтов столб (1800 год) и элемент Волластона, которым пользовался первоначально Георг Ом в собственных исследованиях. Он состоял из медных пластин, свёрнутых в полые цилиндрической форму поверхности: первая вставлена во вторую. Обе ограждены от соприкосновения при помощи деревянных распорок. Электролитом служит разбавленная серная кислота. В результате происходит удвоение рабочих поверхностей. В ходе реакции образуется сульфат меди с выделением водорода, а цинк окисляется. В батарейках один электрод обычно угольный.
- В элементах с двумя жидкостями используется электролит с избытком кислорода для погружения электрода, где образуется водород. В результате происходит химическая реакция образования воды, нестабильность тока компенсируется и сглаживается. Первым идею использования источников выдвинул в 1829 году Беккерель. Первоначально для разделения ёмкостей использовался сосуд из слабо обожжённой глины, обладавший хорошей пористостью. Для компенсации выделения водорода на медном электроде допустимо использовать синий купорос.
Непостоянство источников питания с единственной жидкостью заметил Ом, открыв неприемлемость гальванического элемента Волластона для экспериментов по исследованию электричества. Динамика процесса такова, что в начальный момент времени ток велик и вначале растёт, потом за несколько часов падает до среднего значения. Современные аккумуляторы капризны.
История открытия химического электричества
Мало известен факт, что в 1752 году гальваническое электричество упоминалось Иоганном Георгом. Издание Исследование происхождения приятных и неприятных ощущений, выпущенное Берлинской академией наук, даже придавало явлению вполне правильное толкование. Опыт: серебряную и свинцовую пластины соединяли с одного конца, а противоположные с разных сторон прикладывались к языку. На рецепторах наблюдается вкус железного купороса. Читатели уже догадались, описанный способ проверки батареек часто использовали в СССР.

Химическое электричество
Объяснение явления: видимо, имеются некие частицы металла, раздражающие рецепторы языка. Частицы испускаются одной пластиной при соприкосновении. Причём один металл при этом растворяется. Собственно, налицо принцип действия гальванического элемента, где цинковая пластина постепенно исчезает, отдавая энергию химических связей электрическому току. Объяснение сделано за полвека до официального доклада Королевскому обществу Лондона Алессандро Вольта об открытии первого источника питания. Но, как происходит часто с открытиями, к примеру, электромагнитным взаимодействием, опыт остался незамечен широкой научной общественностью и не исследован должным образом.
Добавим, это оказалось связано с недавней отменой преследования за колдовство: немногие решались после печального опыта «ведьм» на изучение непонятных явлений. Иначе обстояло дело с Луиджи Гальвани, с 1775 года работающим на кафедре анатомии в Болонье. Его специализаций считались раздражители нервной системы, но светило оставил значимый след не в области физиологии. Ученик Беккарии активно занимался электричеством. Во второй половине 1780 года, как следует из воспоминаний учёного (1791, De Viribus Electricitatis in Motu Muscylary: Commentarii Bononiensi, том 7, стр. 363), в очередной раз производилось препарирование лягушки (опыты и потом длились долгие годы).
Примечательно, что необычное явление подмечено ассистентом, в точности, как с отклонением стрелки компаса проводом с электрическим током: открытие сделали лишь косвенно связанные с научными исследованиями люди. Наблюдение касалось подергиваний нижних конечностей лягушки. В ходе опыта ассистент задел внутренний бедренный нерв препарируемого животного, ножки дёрнулись. Рядом, на столе стоял электростатический генератор, на приборе проскочила искра. Луиджи Гальвани немедленно загорелся идеей повторить опыт. Что удалось. И опять на машине проскочила искра.
Опыты Луиджи Гальвани
Образовалась параллель связи с электричеством, и Гальвани возжелал узнать, станет ли на лягушку действовать подобным образом гроза. Оказалось, что природные катаклизмы не оказывают заметного воздействия. Лягушки, прикреплённые медными крючками за спинной мозг к железной ограде, дёргались вне зависимости от погодных условий. Опыты не удавалось реализовать со 100-процентной повторяемостью, атмосфера воздействия не оказывала. В итоге Гальвани нашёл сонм пар, составленных из разных металлов, которые при соприкосновении между собой и нервом вызывали подёргивание лапок у лягушки. Сегодня явление объясняют различной степенью электроотрицательности материалов. К примеру, известно, что нельзя алюминиевые пластины клепать медью, металлы составляют гальваническую пару с ярко выраженными свойствами.
Гальвани справедливо заметил, что образуется замкнутая электрическая цепь, предположил, что лягушка содержит животное электричество, разряжаемое подобно лейденской банке. Алессандро Вольта не принял объяснения. Внимательно изучив описание экспериментов, Вольта выдвинул объяснение, что ток возникает при объединении двух металлов, непосредственно или через электролит тела биологического существа. Причина возникновения тока кроется в материалах, а лягушка служит простым индикатором явления. Цитата Вольты из письма, адресованного редактору научного журнала:
Соединение химических источников питания
| Электрические цепи постоянного тока |
- Электрический ток
- Электрическая цепь и ее элементы
- Закон Ома
- Электрические сопротивле ние и проводимость
- Зависимость сопротивления от температуры
- Проводниковые материалы
- Работа и мощность
- Преобразование электричес кой энергии в тепловую
- Электрическая нагрузка проводов и защита их от перегрузки
- Потеря напряжения в проводах
- Первый закон Кирхгофа
- Последовательное соеди нение сопротивлений
- Параллельное соединение сопротивлений
- Смешанное соединение сопротивлений
- Два режима работы источника питания
- Второй закон Кирхгофа
- Расчет сложных цепей
- Химические источники питания
- Соединение химических источников питания
- Нелинейные электрические цепи
- …
| • Обзор сайта • |
- Электрооборудование до 1000 В
- Электрические аппараты
- Электрические машины
- Эксплуатация электро оборудования
- Электрооборудование электротехнологических установок
- Электрооборудование общепромышленных установок
- Электрооборудование подъемно-транспортных установок
- Электрооборудование металлообрабатывающих станков
- Электрооборудование выше 1000 В
- Электрические аппараты высокого напряжения
- Электротехника
- Электрическое поле
- Электрические цепи постоянного тока
- Электромагнетизм
- Электрические машины постоянного тока
- Основные понятия,отно сящиеся к переменным токам
- Цепи переменного тока
- Трехфазные цепи
- Электротехнические измерения и приборы
- Трансформаторы
- Электрические машины переменного тока
- Электромонтаж
- С чего начинается электро монтаж энергоснабжения электрооборудования и электропроводки
- Монтаж электропроводки
- Расчёт потребляемой мощ ности,сечения кабеля и номинала автоматического выключателя
- Электромонтажные работы и прокладка кабеля в жилых и нежилых помещениях
- Электромонтажные работы по расключению распаечных коробок и электрооборудова ния
- Электромонтаж и заземле ние розеток
- Электромонтаж уравнива ния потенциалов
- Электромонтаж контура заземления
- Электромонтаж модульного штыревого контура заземле ния
- Электромонтаж нагреватель ного кабеля для подогрева полов
- Электромонтажные работы по прокладке кабеля в зем ле
- Электричество в частном доме
- Проект электроснабжения
| • Электротехника • |
- Электрическое поле
- Электрические цепи постоянного тока
- Электромагнетизм
- Электрические машины постоянного тока
- Основные понятия,отно сящиеся к переменным токам
- Цепи переменного тока
- Трехфазные цепи
- Электротехнические измерения и приборы
- Трансформаторы
- Электрические машины переменного тока
- …
ЭЛЕКТРОСПЕЦ
ЭЛЕКТРОСПЕЦ
Если напряжение и ток, необходимые для питания потребителей, превышают соответствующие величины одного источника питания, то применяется соединение нескольких источников в батарею для совместнои работы. Элементы, соединяемые в батарею, должны иметь одинаковые э. д. с. Е0 и одинаковые внутренние сопротивления r0. Последовательное соединение элементов (рис. 2-16) применяется в том случае, если ток потребителя не превышает номинальный ток одного элемента, а напряжение потребителя U больше э. д. с. элемента (E0). В этом случае число элементов n, соединенных последовательно, определяется отношением n >= U/E0 . При одинаковом направлении э. д. с, для чего отрицательный зажим одного элемента должен соединяться с положительным зажимом следующего и т. д., э. д. с. батареи в n раз больше э. д. с. элемента:
внутреннее сопротивление батареи
Разрядный ток батареи равен разрядному току элемента.
Параллельное соединение элементов (рис. 2-17) применяется в том случае, если напряжение потребителя U равно напряжению элемента U0, а сила тока потребителя I значительно больше разрядного тока элемента Iр. В этом случае число элементов m, соединенных параллельно, определяется отношением m >= I/Iр. При этом способе соединения положительные зажимы всех элементов соединяются в один узел, а отрицательные зажимы — в другой, таким образом, э. д. с. батареи E равна э. д. с. Е0 каждого элемента:
внутреннее сопротивление батареи
разрядный ток батареи в m раз больше разрядного тока элемента:
Групповое соединение — это сочетание последовательного и параллельного соединений элементов (рис. 2-18). Оно применяется в тех случаях, когда напряжение и ток потребителя больше номинального напряжения и тока элемента. Число последовательно соединенных элементов n в группе и число параллельных групп m определяются по ранее приведенным формулам.