Пример гальванического элемента
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля. Он включает в себя которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод). Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.
Гальванические элементы: преимущества и недостатки
Для изготовления современных гальванических элементов используются самые различные материалы. Наиболее распространенными являются материалы на основе угольно-цинковых элементов, используемых для пальчиковых .
Их основным положительным качеством считается относительно низкая стоимость. Однако, такие элементы обладают невысокой мощностью и небольшим сроком хранения. Наиболее оптимальным вариантом служит использование щелочных элементов. Здесь в качестве электролита выступает не уголь, а раствор щелочи. При разрядке не происходит выделение газа, что позволяет обеспечить полную герметичность. Щелочные элементы отличаются более высоким сроком хранения.
Общий принцип работы гальванического элемента для всех их видов совершенно одинаковый. Например, элементы на основе оксида ртути конструктивно напоминают щелочные. Они отличаются повышенной устойчивостью к высокой температуре, высокой механической прочностью и стабильным значением напряжения
Недостатком является токсичность ртути, требующая осторожного обращения с отработанными элементами
Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение.
Рассмотрим как работает электрическая батарейка и какие реакции взаимодействия происходят между ее химическими компонентами:
- Отрицательно заряженные ионы гидроксида (2OH-) взаимодействуют с цинком (Zn) в анодной секции. В результате химической реакции окисления получается гидроксид цинка (Zn(OH)2) и высвобождаются молекула воды и отрицательно заряженные электроны. Эти электроны теперь свободны для перемещения, и они собираются на латунном штыре (токоотводе отрицательного электрода).
- В то же время диоксида марганца (2MnO2) соединяется с молекулой воды (H2O) из электролита, а также со свободным электроном. Во время такой химической реакции восстановления диоксид марганца превращается в оксид марганца (Mn2O3). Оксид марганца больше не нуждается в атоме гидроксид-иона, поэтому он будет выбрасывать его в электролит.
- Таким образом, появляется скопление электронов на отрицательном конце батарейки. Поскольку больше отрицательно заряженных электронов на отрицательном полюсе по сравнению с положительным, образуется разность напряжений между ними, и эту разность можно измерить с помощью мультиметра.
- Электроны отталкиваются друг от друга и хотят переместиться в область с меньшим количеством электронов. Но сепаратор не позволяет им течь внутри батареи, чтобы достичь положительной клеммы. Если обеспечить электронам внешний путь (например подключив лампочку), то электроны будут течь через него и выполнять работу (заставлять лампу светится).
Наглядно понять, как работает батарейка и что у нее происходит внутри, можно, ознакомившись с представленной ниже видео демонстрацией.
Меднение изделия
Перед началом работ по меднению в домашних условиях нужно подготовить необходимые материалы и оборудование. Надо позаботится об источнике напряжения и постоянного тока. Существует много рекомендаций касательно силы тока, разброс которого может быть большим. Поэтому желательно иметь реостат с возможностью плавной регулировки напряжения и для постепенного завершения процесса. Источником может служить автомобильный аккумулятор или выпрямитель с напряжением на выходе не больше 12 вольт. Для первых опытов будет достаточно обычной батарейки от 4.5 до 9 вольт.
Затем выбирается ёмкость для электролитического раствора, лучше всего из жаропрочного стекла. В любом случае все ёмкости для электролиза должны быть диэлектриками и выдерживать температуру не менее, чем 80 градусов по Цельсию.
В качестве анодов подойдут два больших медных листа. Они должны перекрывать по размеру заготовку. Из химических реактивов потребуются:
- Купорос медный.
- Кислота соляная либо серная.
- Вода дистиллированная.
Меднение в домашних условиях пользуется заслуженной популярностью, поскольку очень хорошо и надежно держится на стальных изделиях. Главное условие — правильно соблюдать технологию процесса.
Имеется два способа нанесения меди на поверхность:
- Помещение заготовки в раствор электролита.
- Неконтактный способ. В этом случае изделие не погружается в раствор.
Метод погружения
Подготавливается и обрабатывается поверхность изделия при помощи тонкого наждака и щеточки. После этого деталь моется в проточной воде, обезжиривается и еще раз промывается.
Этапы процесса омеднения следующие:
- Два медных анода подключают в сеть к положительным контактам и размещают их в стеклянную банку.
- К обработанному изделию подводят контакт с отрицательным значением напряжения и свободно подвешивают между анодами.
- Подключают реостат согласно электрической схеме для возможности регулирования силы тока.
- Подготавливается раствор в правильных пропорциях. На 100 г дистиллированной воды надо 20 г медного купороса и 2−3 г соляной кислоты. Вместо соляной кислоты можно использовать другую.
- Раствор выливается в посуду с медными пластинами и деталью таким образом, чтобы они полностью скрылись под поверхностью раствора.
- Подключается источник напряжения. Реостатом добиваются необходимой силы тока из примерного расчета 10−15 миллиампер на каждый квадратный сантиметр площади детали.
Покрытие медью без погружения
Этот метод интересен тем, что его можно использовать для обработки не только стальных предметов, но и сделанных из других материалов. Например, алюминия и цинка. Порядок процесса следующий:
- Из многожильного медного провода изготавливается «кисточка». Конец провода оголяется. Из медных проводков создается подобие кисточки, чтобы затем прикрепить ее к деревянной ручке-держателю.
- Второй конец провода подключается к плюсовому контакту электрической цепи.
- В широкую ёмкость заливается стандартный электролитный раствор из медного купороса и соляной кислоты.
- Предварительно очищенная и промытая металлическая заготовка присоединяется к отрицательному контакту и размещается в пустой ёмкости.
- Импровизированная кисточка окунается в раствор электролита и проводится по поверхности заготовки без контакта. Это действие повторяется до получения результата.
https://youtube.com/watch?v=RVbR6LBkHdA
Обработка алюминия
Часто с помощью медного электролиза обновляют столовые приборы, сделанные из алюминия. Если нет опыта проведения этого процесса, то можно потренироваться нанести медь на алюминиевые пластинки. Порядок проведения процесса:
- Алюминиевую пластинку зачищают и обезжиривают.
- Наносят на неё небольшое количество раствора медного купороса.
- Подсоединяют отрицательную клемму от источника питания к алюминиевой пластинке. Удачным способом соединения является металлический зажим-крокодил.
- Положительный полюс питания подается на медную «щеточку». Это конструкция из медного провода, один конец которого освобожден от оплетки, а медные щетинки образовали кисточку. Зажим от питания присоединяется ко второму концу провода. Сечение провода должно быть от одного до полутора миллиметров.
- Медную щетину обмакивают в раствор сернокислой меди и водят на близком расстоянии от поверхности алюминиевой пластинки. При этом нужно стараться не прикасаться щеточкой к заготовке, чтобы не замкнуть цепь.
- Омеднение происходит буквально на глазах.
- После окончания работы с пластины удаляют остатки не закрепившейся меди и протирают спиртом.
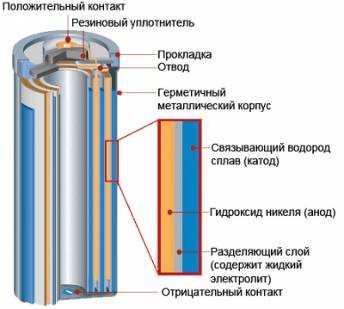
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Элемент Даниэля – тип гальванических элементов, созданный британским химиком и метеорологом Джоном Фредериком Даниэлем в 1836 году и состоящий из медных сосудов, заполненных раствором сульфата меди (II), куда погружен глиняный контейнер, заполненный серной кислотой, и цинковый электрод. Он искал способ устранить проблему с пузырьками водорода, обнаруженную в вольтовом столбе, и решением стало использование второго электролита для потребления водорода, выработанного вначале. Сульфат цинка можно заменить серной кислотой. Элемент Даниэля стал серьезным прогрессом в отношении к уже существовавшим технологиям, которые использовались на заре разработки аккумуляторных батарей. Более поздняя модель элемента Даниэля, называемая гравитационным элементом, была изобретена в 1860-х годах французом по имени Калло, и стала распространенным вариантом для телеграфии.
Элемент Даниэля также стал исторической основой для современного определения вольта, ставшего единицей электродвижущей силы в Международной системе единиц. Определения единиц измерения тока, предложенные на Международной электрической выставке 1881 года, предполагали, что электродвижущая сила элемента Даниэля составит около 1 В. С учетом современных определений, стандартное напряжение элемента Даниэля при 25 °С, фактически, составляет 1,1 В.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Принцип действия
Учёные помещали в ёмкости с кислотой медную и цинковую пластинку. Их соединяли проводником, на первой образовывались пузырьки газа, вторая начинала растворяться. Это доказывало то, что по проводнику протекает электрический ток. После Гальвани опытами занялся Вольт. Он создал элемент цилиндрической формы, похожий на вертикальный столбец. В его составе были цинковые, медные и суконные кольца, предварительно пропитанные кислотой. Первый элемент имел высоту в 50 см, и выработанное им напряжение чувствовалось человеком.
Принцип работы заключается в том, что два вида металла в электролитической среде вступают во взаимодействие, в результате которого по внешней цепи начинает проходить ток. Современные гальванические элементы и аккумуляторы называют батарейками. Их напряжение зависит от используемого металла. Устройство помещено в цилиндр из мягкой жести. В качестве электродов выступают сетки с окислительным и восстановительным напылением.
 Преобразование химической энергии в электричество исключает возможность восстановления свойств батареек. Ведь при работе элемента реагенты расходуются, из-за чего уменьшается ток. Восстановителем обычно служит отрицательный вывод из лития или цинка. Во время функционирования он теряет электроны. Положительную часть изготавливают из металлических солей или оксида магния, она выполняет работу окислителя.
Преобразование химической энергии в электричество исключает возможность восстановления свойств батареек. Ведь при работе элемента реагенты расходуются, из-за чего уменьшается ток. Восстановителем обычно служит отрицательный вывод из лития или цинка. Во время функционирования он теряет электроны. Положительную часть изготавливают из металлических солей или оксида магния, она выполняет работу окислителя.
Самодельный простой гальванический элемент. Зарядка мобильного телефона без электросети. | ДелайСам.Ру
Те, кто на даче не имеют электричества, наверняка испытывают определенные неудобства в самых элементарных вещах. Ну ладно там, нет холодильника или телевизора… Но ведь порой даже мобильный телефон подзарядить нет возможности. Запасных аккумуляторов — не напасешься и не навозишься.
Между тем, существует довольно простой способ получить электрический ток достаточный для работы простейших электронных устройств прямо на месте и без больших затрат.
Да, лампочку к такому источнику не подключить, но обеспечить электропитанием небольшой радиоприемник или подзарядить мобильник ему вполне по силам. Такой же источник сможет зарядить небольшие аккумуляторы и в походе, пока туристы спят или отдыхают.
И что особенно ценно, данный источник стоит буквально копейки, работает независимо ни от каких погодных условий и не имеет вообще никаких подвижных частей.
Принцип работы данного источника тока основан на том, что некоторые металлы образуют между собой т.н. гальванические пары. Т.е.
при их соприкосновении образуется простейший гальванический элемент, вырабатывающий электрический ток. Например, по этой причине нельзя соединять напрямую провода из меди и алюминия.
Если два электрода из таких металлов поместить в электролит, они начнут вырабатывать электрический ток. Почему же не использовать этот эффект для того, что бы решить хотя бы одну проблему — с той же зарядкой мобильного телефона в условиях отсутствия электросети.
При устройстве такого простейшего элемента можно использовать в качестве электродов любые медные и железные отрезки проволоки, а лучше — пластины. Пластины дадут бОльший ток. А качестве электролита подойдет сырая земля (грунт), которую лучше пропитать солевым раствором.
Что бы не портить землю на своем участке, лучше насыпать землю в ведра (можно и дырявые) или даже в полиэтиленовые пакеты.
Разумеется, напряжение такого элемента невелико — 0,5-1 вольт максимум. А ток, который он вырабатывает 20-50 мА. Но что нам мешает сделать несколько таких элементов и соединить их последовательно! Таким образом мы достигнем необходимого напряжения, достаточного для зарядки аккумулятора мобильного телефона или другого устройства.
Разумеется, такой элемент примитивен, имеет невысокий КПД. Но! Во-первых, он крайне дешев и делается действительно из материалов, которые валяются под ногами — (проволока, обрезки труб, пластины металла).
Во-вторых, он не требует никаких телодвижений с вашей стороны после его изготовления. Он необслуживаемый! Один раз сделал — пользуйся весь сезон. Ну разве что поливай периодически, поддерживая влажности грунта.
В третьих — сделать его по силам даже школьнику младших классов.
Такими элементами пользовались еще на заре электроники, когда батареи были очень дефицитны и дороги. Теперь же с появлением весьма экономичных и низковольтных электронных приборов массового пользования они возможно кому то снова смогут принести пользу.
К. Тимошенко
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:

В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.

Возникает так называемый двойной электрический слой.

Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:
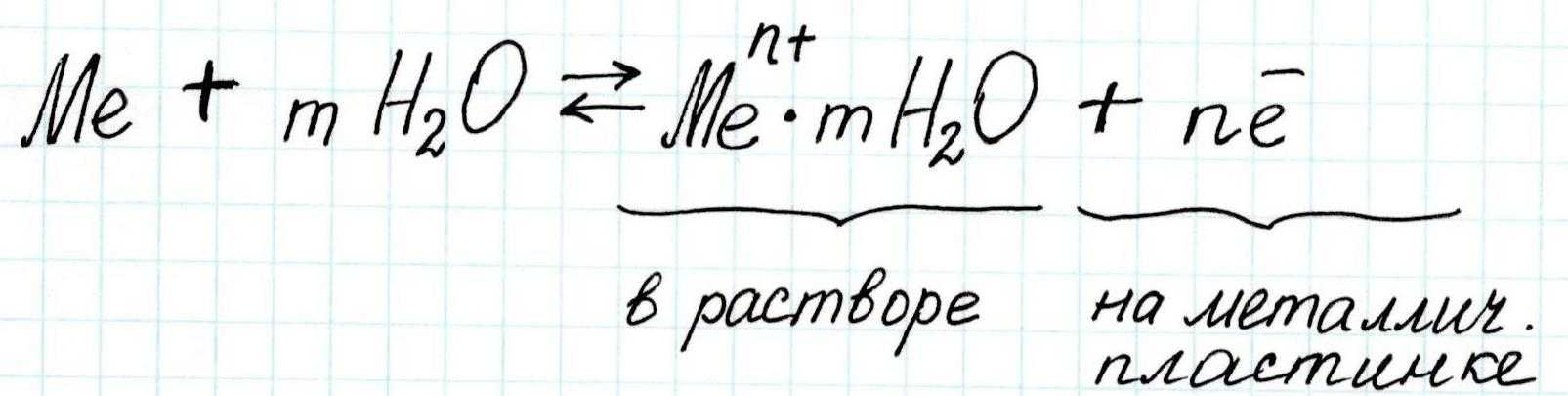
На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn2+. Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:
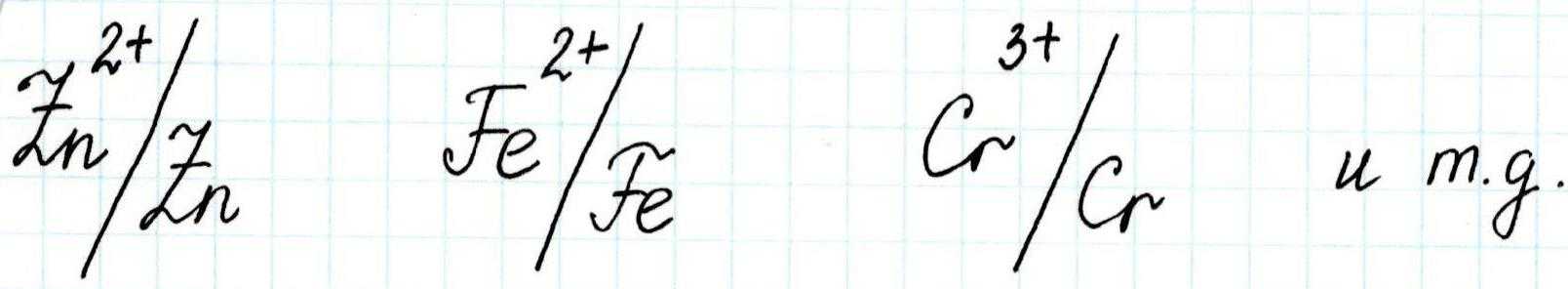
Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu2+из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO42-и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.
Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
Принцип действия гальванического элемента
При соединении полюсов с помощью проводника происходит появление простейшей электрической цепи. Протекание тока внутри элемента будет происходить от отрицательного заряда к положительному, то есть от цинковой пластины к медной. Движение заряженных частиц по внешней цепи будет осуществляться в обратном направлении.
При воздействии электрического тока движение остатков серной кислоты, а также ионов водорода будет происходить в различных направлениях. При этом, водород передает заряд на медную пластину, а остаток кислоты — на цинковую пластину. Таким образом, на клеммах будет осуществляться поддержка напряжения. Одновременно, на медной пластине оседают пузырьки водорода, ослабляющего общее действие элемента и создающего дополнительное напряжение. Такое напряжение известно, как электродвижущая сила поляризации. Чтобы избежать этого явления, в состав вводится вещество, способное поглощать атомы водорода и выполнять функцию деполяризации.
Схема гальванического элемента
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
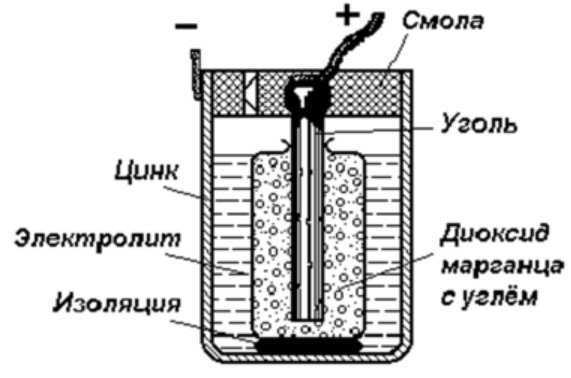
Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Принцип работы гальванических элементов
Первая такая электрохимическая система была предложена итальянским ученым Алессандро Вольта. Она представляет собой цинковые и медные пластины, между которыми находится сукно, увлажненное серной кислотой: ZnH+CuZn/H^+/CuZnH+Cu.
Согласно схеме данного гальванического элемента CuSО4CuSО_4CuSО4-ZnSО4ZnSО_4ZnSО4, в нем происходят следующие процессы:
Катод(+) Cu2++2→CuCu^{2+} +2 → Cu^0Cu2++2→Cu
Aнод(–) Zn→Zn2++2Zn^0 → Zn^{2+}+ 2Zn→Zn2++2
Результирующий процесс Cu2++Zn→Zn2++CuCu^{2+} + Zn^0 → Zn^{2+} + Cu^0Cu2++Zn→Zn2++Cu
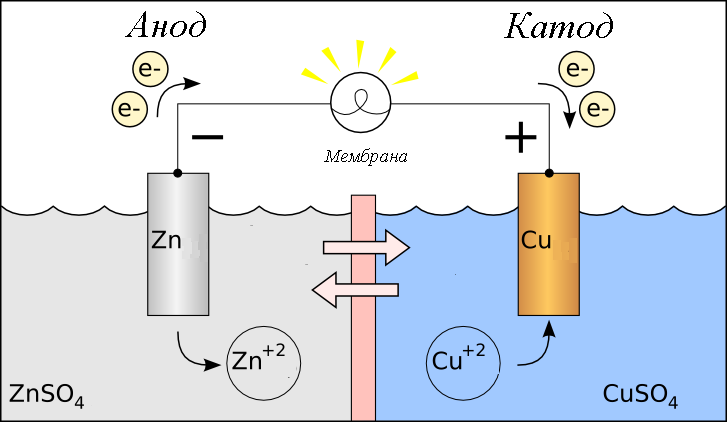
Принципиальная схема гальванического элементаCuSО4CuSО_4CuSО4-ZnSО4ZnSО_4ZnSО4
Электроны направляются из медного электрода к серебряному. Электрод на котором протекает процесс окисления (Zn→Zn2+Zn^0 → Zn^{2+}Zn→Zn2+, процесс окисления) будет анодом, электрод на котором происходит процесс восстановления (Cu2+→CuCu^{2+} → Cu^0Cu2+→Cu, процесс восстановления) – катодом. В гальваническом элементе анод заряжен отрицательно, катод – положительно.
E=Δ<msubsup>E</msubsup>−Δ<msubsup>E.</msubsup>=Δ<msubsup>E</msubsup>−Δ<msubsup>E</msubsup>=Δ<msubsup>ECu2+Cu</msubsup>−Δ<msubsup>EZn2+Zn</msubsup>=,34−(−,76)=1,1B{{E}^{0}}=\Delta E_{}^{0}-\Delta E_{.}^{0}=\Delta E_{}^{0}-\Delta E_{}^{0}=\Delta E_{C{{u}^{2+}}/C{{u}^{0}}}^{0}-\Delta E_{Z{{n}^{2+}}/Z{{n}^{0}}}^{0}=0,34-(-0,76)=1,1BE=ΔE−ΔE=ΔE−ΔE=ΔECu2+Cu−ΔEZn2+Zn=,34−(−,76)=1,1B
Способность каждого химического элемента подвергаться в гальваническом устройстве окислению или, наоборот, восстановлению можно установить, оценивая его электродный потенциал. Например, катод, потенциал которого имеет более высокую алгебраическую величину (более положительное значение), представляет собой положительный полюс внешнего круга гальванического элемента, тогда как анод, имея меньшую величину этого потенциала (более отрицательное значение), будет отрицательным полюсом.
Перед началом работы гальванического элемента в обоих растворах количество катионов строго соответствует числу анионов. В процессе эксплуатации гальванического элемента в раствор ZnSО4ZnSО_4ZnSО4 непрерывно поступают катионы цинка, поэтому анионов становится недостаточно для образования молекулярной вещества, а с раствор CuSО4CuSО_4CuSО4 катионы меди постоянно восстанавливаются на медном катоде, поэтому образуется избыток анионов, которые движутся через солевой мостик или электрохимический ключ от раствора CuSО4CuSО_4CuSО4 к раствору ZnSО4ZnSО_4ZnSО4.
В момент замыкания проводником двух электродов между двумя металлами возникает потенциал, называемый контактным.
Химические источники электрического тока
Химические источники тока – это устройства, работа которых обусловлена преобразованием выделяемой при окислительно-восстановительном процессе химической энергии в энергию электрическую.
К преимуществам химических источников тока относится универсальность их применения.
Источником питания многих бытовых устройств, а также приборов, используемых в научных лабораториях или на производстве, являются именно химические источники питания.
Востребованность химических источников тока в обеспечении функционирования аппаратуры связи или портативной электронной аппаратуры заслуживает особого внимания, так как в этом случае они являются незаменимыми.
Химические источники электротока
Конструктивно химические источники тока представляют собой два металлических электрода, разделенных электролитом. Электроды изготавливаются из металла, который является проводником электронов (электронная проводимость), а электролит изготавливается из жидкого или твердого вещества, являющегося проводником ионов (ионная проводимость).
Если для питания, какого либо потребителя, требуется высокое напряжение, то электрические аккумуляторы соединяются последовательно. В случае, когда для электропитания требуется большой ток, электрические аккумуляторы соединяются параллельно и носят название аккумуляторной батареи.
Советуем изучить Экспертиза электрооборудования: профессиональный подход к важнейшему вопросу
Последовательное соединение (согласное включение)
Еобщ = Е1 + Е2 + Е3
Смешанное соединение (встречное)
Еобщ = Е1 – Е2 + Е3
- Параллельное соединение источников питания. ( Такое соединение применяется
- для увеличения тока в цепи. )
Еобщ = Е1 = Е2 = Е3
В зависимости от характера работы различные типы химических источников питания носят название гальванических элементов либо электрических аккумуляторов.
К отличительной особенности химических источников тока, называемых гальваническими элементами, относится возможность одноразового применения, так как их выделяющие электрическую энергию активные вещества подлежат полному распаду в процессе химической реакции. При полном разряде гальванического элемента его дальнейшее применение невозможно.
Особенностью таких химических источников тока, как электрические аккумуляторы, является их многоразовое использование за счет обратимости основных действующих процессов.
Разряженный электрический аккумулятор обладает способностью регенерировать свои дающие электрическую энергию активные вещества за счет процесса пропускания через него постоянного тока, источником которого служит другое устройство.
При заряде электрического аккумулятора постоянный тока другого источника должен протекать в направлении, противоположном разрядному току. Такое условие способствует замене реакции окисления на реакцию восстановления на положительном электроде, и наоборот, на отрицательном электроде реакция окисления заменяется на реакцию восстановления.
К химическим источникам тока предъявляется ряд общих и специальных технических требований. Все требования оговорены в соответствующей нормативной документации.
Общими являются требования: к габаритно-массовым характеристикам; к надежности; к отсутствию вредного влияния на окружающую среду; к безопасному использованию обслуживающим персоналом; к сроку службы; к минимальному саморазряду.
Специальными техническими условиями являются требования к удельным характеристикам, к механической прочности, к температурному диапазону рабочего режима, к невысокому значению внутреннего сопротивления, к работоспособности в любом положении, к удобству в эксплуатации.
Принцип действия гальванического элемента
При соединении полюсов с помощью проводника происходит появление простейшей электрической цепи. Протекание тока внутри элемента будет происходить от отрицательного заряда к положительному, то есть от цинковой пластины к медной. Движение заряженных частиц по внешней цепи будет осуществляться в обратном направлении.
При воздействии электрического тока движение остатков серной кислоты, а также ионов водорода будет происходить в различных направлениях. При этом, водород передает заряд на медную пластину, а остаток кислоты — на цинковую пластину. Таким образом, на клеммах будет осуществляться поддержка напряжения. Одновременно, на медной пластине оседают пузырьки водорода, ослабляющего общее действие элемента и создающего дополнительное напряжение. Такое напряжение известно, как электродвижущая сила поляризации. Чтобы избежать этого явления, в состав вводится вещество, способное поглощать атомы водорода и выполнять функцию деполяризации.
Устройство и принцип работы гальванического элемента
Металл, погруженный в раствор электролита, называется электродом.
Электроды — это система двух токопроводящих тел — проводников первого и второго рода.
К проводникам первого рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда — электроны.
К проводникам второго рода относятся расплавы и растворы электролитов; носители заряда — ионы.
Устройство, состоящее из двух электродов, называется гальваническим элементом.
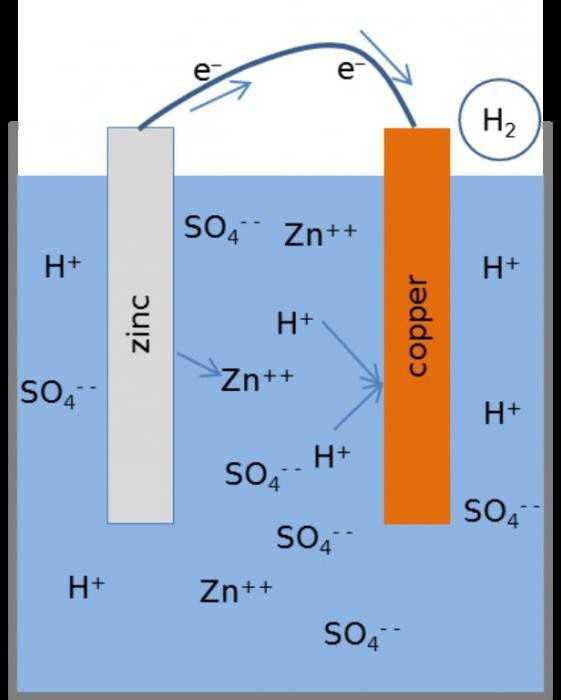
| Рис. 2. Схема медно-цинкового гальванического элемента |
Рассмотрим гальванический элемент Якоби—Даниэля (схема приведена на рис. 2). Он состоит из цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
В гальваническом элементе электрод, сделанный из более активного металла, т.е. металла, расположенного левее в ряду напряжений, называют анодом, а электрод, сделанный из менее активного металла — катодом.
На поверхности цинкового электрода (анода) возникает двойной электрический слой и устанавливается равновесие:
Zn0 – 2ē ←→ Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медного электрода (катода) также возникает двойной электрический слой и устанавливается равновесие:
Cu2+ + 2ē ←→ Cu0.
В результате возникает электродный потенциал меди.
Так как потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, то при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате этого процесса равновесие на цинковом электроде смещается вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы или не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе гальванического элемента Якоби—Даниэля протекают следующие процессы:
1. Анодный процесс, процесс окисления:
2. Катодный процесс, процесс восстановления:
3. Движение электронов во внешней цепи.
4. Движение ионов в растворе: анионов SO42– к аноду, катионов Cu2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получим:
Zn + Cu2+ = Zn2+ + Cu.
В результате протекании данной реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. Поэтому суммарную химическую реакцию, протекающую в гальваническом элементе, называют токообразующей реакцией.
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделенными: на отрицательном электроде (аноде) происходит процесс окисления, на положительном электроде (катоде) — процесс восстановления.
Необходимым условием работы гальванического элемента является разность потенциалов электродов. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности между потенциалом катода и потенциалом анода элемента:
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определенный порядок в записи схемы элемента: записанный слева электрод должен быть отрицательным. Например, схема элемента Якоби—Даниэля записывается в виде:
Zn │ ZnSO4 ║ CuSO4 │ Cu .































