Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H+ и OH- как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К−: 4H2O + 4e− = 2H2 + 4OH−
А+: 2H2O − 4e− = O2 + 4H+
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.

-
Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
-
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
-
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
-
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
-
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:

Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:

Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
-
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
-
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
-
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.

Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
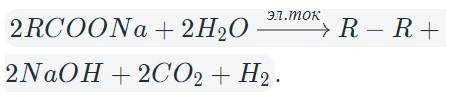
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Бесплатные занятия по английскому с носителем Занимайтесь по 15 минут в день. Осваивайте английскую грамматику и лексику. Сделайте язык частью жизни. Записаться на интенсив

Таблица изменения веществ с помощью электролиза
Усиление восстановительных способностей веществ:
| Na+ | Mg2+ | Al3+ | Zn2+ | Fe3+ | Ni2+ | Sn2+ | Pb2+ | H+ | Cu2 | Ag+ |
| Натрий | Магний | Алюминий | Цинк | Железо | Никель | Олово | Свинец | Водород | Медь | Серебро |
Усиление окислительных способностей веществ:
| I- | Br- | Cl- | OH- | NO3- | CO32- | SO42-. |
| Йодид (соли, образованные йодоводородной кислотой) | Бромид (соли, образованные бромоводородной кислотой) | Хлорид (соли, образованные соляной кислотой) | Гидроксид | Нитрат (соли, образованные азотной кислотой) | Карбонат (соли, образованные угольной кислотой) | Сульфат (соли, образованные серной кислотой) |
| Катод (отрицательный) | Анод (положительный) |
| Восстановление катионов после водорода | Окисление анионов кислот, не содержащих кислорода |
| Восстановление катионов, имеющих среднюю активность | Окисление анионов оксокислот |
| Восстановление наиболее активных катионов | Окисление анионов гидроксидов |
| Восстановление катионов водорода |
Электролиз с растворимыми электродами
В этом случае электролиз металлов осуществляется при помощи электродов, выполненных из того же М, который присутствует в электролите. Также электроды могут быть изготовлены из М активностью выше.
Важно! При протекании этого процесса на аноде восстанавливаются не анионы или молекулы H2O, а окисляется сам анод. Его частицы растворяются (окисляются) и восстанавливаются уже на катоде. В случае с медным анодом при электролизе меди, где электролитом является сульфат меди, происходит следующее:
В случае с медным анодом при электролизе меди, где электролитом является сульфат меди, происходит следующее:
- ионы меди, входящие в раствор, восстанавливаются на катоде: Cu2+ + 2ē → Cu0;
- медный анод подвергается окислению своих частиц меди: Cu0 – 2ē → Cu2+.
Таким образом, если медную заготовку, имеющую примеси, использовать в качестве анода при гальванолизе в сульфате меди, то на катоде будет оседать медь в чистом виде. Анодный электрод при этом будет растворяться.
Электролиз с растворимыми анодами
Вот перечень некоторых металлов, которые могут быть растворимыми электродами:
- медь (Cu);
- серебро (Ag);
- цинк (Zn);
- кобальт (Co);
- олово (Sn);
- никель (Ni);
- кадмий (Cd).
На растворимом аноде в начальной стадии электролиза процессы проходят при минимальном стандартном потенциале на электроде. Если электролиз не остановить, то значение потенциала отклоняется в отрицательную сторону. Это вызвано поляризацией из-за пребывания на катоде электронов.
К сведению. Потенциалы электродов могут отклоняться от их изначального значения в ходе электролиза. Это явление называют поляризацией. Она бывает электрохимической и концентрационной.
Активные металлы
Это тот тип металлов, который легко вступает в реакции. В периодической таблице это элементы 1-й и 2-й группы. Так как металлические свойства у элементов становятся слабее в ряду слева направо, то к ним относятся:
- щелочные металлы: литий, калий, натрий, цезий, франций, рубидий;
- щелочноземельные элементы: бериллий, магний, кальций, стронций, барий, радий;
- алюминий.
Данные металлы имеют один или два валентных электрона и легко их отдают, являясь восстановителями. К отличительным особенностям активных металлов относятся:
- мягкость;
- лёгкость;
- низкая температура плавления.
При взаимодействии с кислородом (на воздухе) щелочных металлов возможно самовозгорание. Самовозгорание щелочноземельных металлов происходит при повышении температуры. При взаимодействии их с водой образуются щёлочь и водород, вступая в реакцию с кислотами, они образуют соли.
Менее активные металлы и неактивные металлы
Среднюю активность проявляют металлы, стоящие в ряду после алюминия Al и до водорода H2.
К неактивным относятся элементы, стоящие правее водорода: медь (Cu), ртуть (Hg), серебро (Ag), платина (Pt), золото (Au).
Таблица химической активности металлов
Электролиз +
И вот сейчас вроде бы можно испытать известную гордость: если Фарадей, открывший эти законы, великий (правда, он еще много чего другого наоткрывал!), то и мы вроде бы не лыком шиты, раз смогли их так изящно, в две строчки, обосновать. Ан нет, увы нам: Фарадей потому и великий, что во времена, когда ничего не было известно ни об электронах, ни об ионах, ни о числах Авогадро и многом-многом прочем, он своим гениальным прозрением сумел так осознать и осмыслить огромное количество экспериментального материала, наработанного собственным денным и нощным трудом, что все результаты подчинилось двум несложным правилам, осветившим ярким факелом дорогу дальнейшего развития и физики, и химии. Это все равно что покорить Эверест и посмотреть фильм о покорении Эвереста, так вот мы – просто зрители, но хоть понимаем, про что кино, и то хорошо.
Применим полученные знания к решению задачи.
Задача
В процессе электролиза под действием тока плотностью 300 А/м2 на электроде выделился слой меди толщиной 0,03 мм. В течение какого времени протекал процесс?
Дано: d = 3 ⋅ 10 − 5 d=3\cdot10-5 d=3⋅10−5 м j = 300 j=300 j=300 А/м2 τ τ τ = ? ? ?
Решение
Для решения воспользуемся вторым законом Фарадея. Если площадь электрода S S S, плотность меди ρ ρ ρ, то выделившаяся при электролизе масса m = ρ S d = j S τ m = ρSd = jSτ m=ρSd=jSτ, поскольку в данных обстоятельствах сила тока I = j S I = jS I=jS, а валентность меди равна 2.
Кроме того, согласно справочнику плотность меди ρ = 8 , 9 ⋅ 103 ρ =8,9 \cdot 103 ρ=8,9⋅103 кг/м3, а масса моля меди μ = 0 , 0635 \mu = 0,0635 μ=0,0635 кг/моль.
Следовательно, τ = 2 ρ d N A e j μ τ = \frac{2ρdN_Ae}{j\mu} τ=jμ2ρdNAe, т.е. τ = 2 ⋅ 8 , 9 ⋅ 103 ⋅ 3 ⋅ 10 − 5 ⋅ 6 ⋅ 1023 ⋅ 1 , 6 ⋅ 10 − 19 300 ⋅ 63 , 5 ⋅ 10 − 3 = 27 ⋅ 102 τ = \frac{2\cdot8,9\cdot103\cdot3\cdot10-5\cdot6\cdot1023\cdot1,6\cdot10-19}{300\cdot63,5\cdot10-3} = 27\cdot102 τ=300⋅63,5⋅10−32⋅8,9⋅103⋅3⋅10−5⋅6⋅1023⋅1,6⋅10−19=27⋅102 с = 45 45 45 мин.
Ответ: τ = 2 ρ d N A e j μ = 45 τ = \frac{2ρdN_Ae}{j\mu} = 45 τ=jμ2ρdNAe=45 минут.
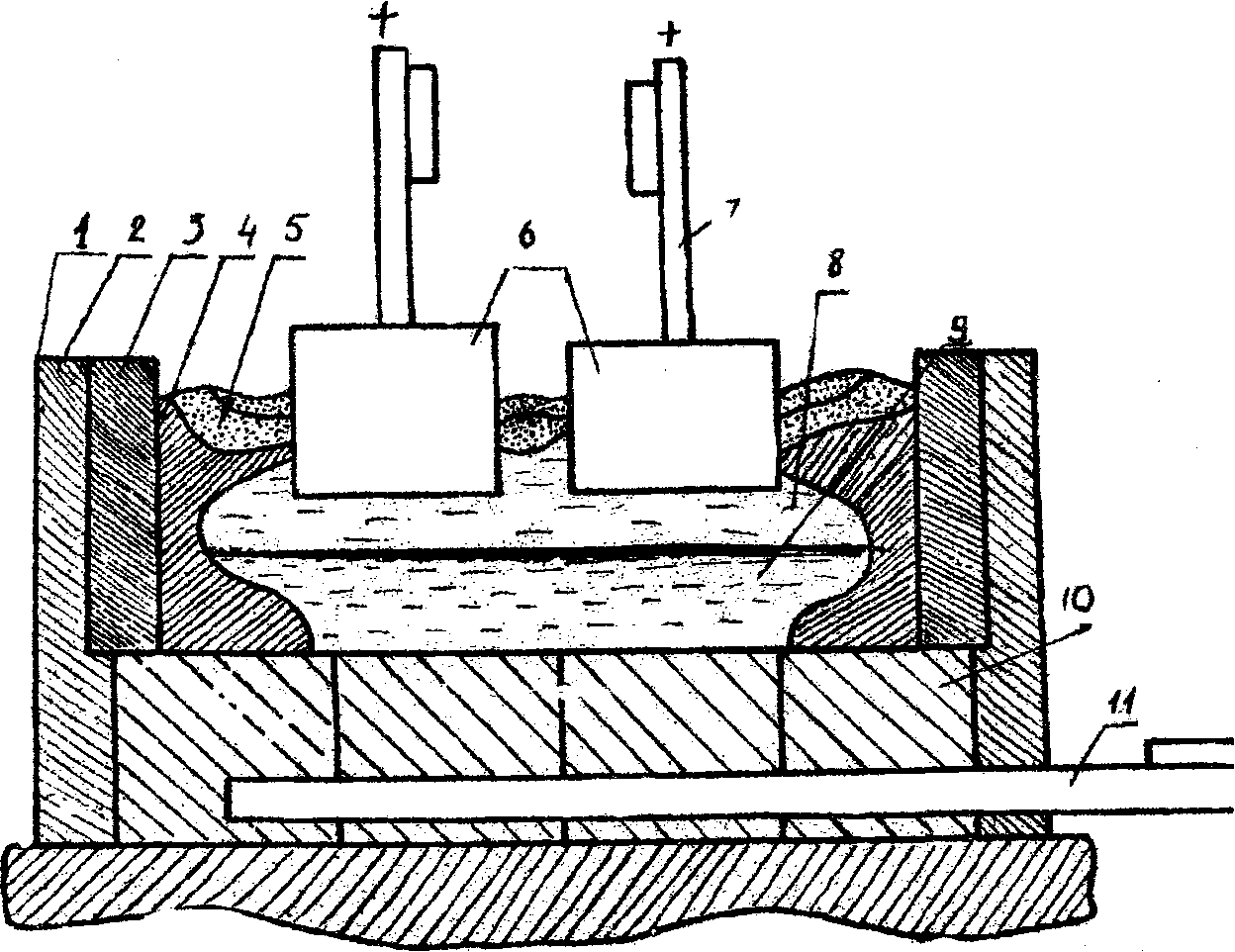
§ 3.6. Техническое применение электролиза
Электролиз находит широкое применение в технике. Рассмотрим лишь некоторые примеры наиболее важных технических применений электролиза.
Гальваностегия — покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, серебрение, золочение и т. д.) с целью предохранения от окисления и придания изделию привлекательного внепгнего вида.
Предмет, подлежащий покрытию, тщательно очищают, хорошо обезжиривают и помещают в качестве катода в электролитическую ванну, содержащую раствор соли того металла, которым должен быть покрыт данный предмет (рис. 3.8). Анодом служит пластинка из того же металла. Для более равномерного покрытия обычно применяют две пластинки в качестве анода, помещая предмет между ними (см. рис. 3.8).
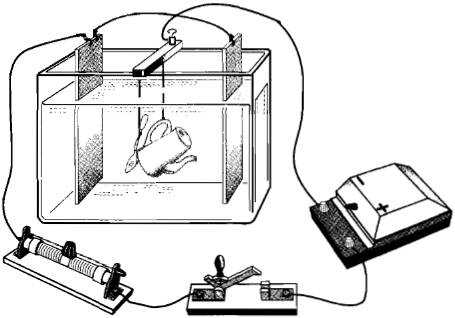
Рис. 3.8
Гальванопластика — электролитическое изготовление копий с рельефных предметов (медалей, гравюр, барельефов и т. д.). С рельефного предмета делают восковый или иной слепок. Затем поверхность слепка покрывают тонким слоем графита, чтобы она стала проводящей. В таком виде слепок используется в качестве катода, который опускают в электролитическую ванну с раствором медного купороса. Анодом служит медная пластинка
Когда на слепке нарастет достаточно толстый слой меди, электролиз прекращают и воск осторожно удаляют. Остается точная медная копия оригинала
В полиграфической промышленности такие копии (стереотипы) получают с оттиска набора на пластичном материале (матрица), осаждая на матрицах толстый слой железа или другого материала
Это позволяет воспроизвести набор в нужном количестве экземпляров. Если раньше тираж книги ограничивался числом оттисков, которые можно получить с одного набора (при печатании набор стирается), то использование стереотипов позволяет значительно увеличить тираж
В полиграфической промышленности такие копии (стереотипы) получают с оттиска набора на пластичном материале (матрица), осаждая на матрицах толстый слой железа или другого материала. Это позволяет воспроизвести набор в нужном количестве экземпляров. Если раньше тираж книги ограничивался числом оттисков, которые можно получить с одного набора (при печатании набор стирается), то использование стереотипов позволяет значительно увеличить тираж.
Правда, в настоящее время с помощью электролиза получают стереотипы только для книг высококачественной печати и с большим числом иллюстраций.
Осаждая металл на длинный цилиндр, получают трубы без шва.
Процесс получения отслаиваемых покрытий был разработан русским ученым Б. С. Якоби, который в 1836 г. применил этот способ для изготовления полых фигур для Исаакиевского собора (в Санкт-Петербурге).
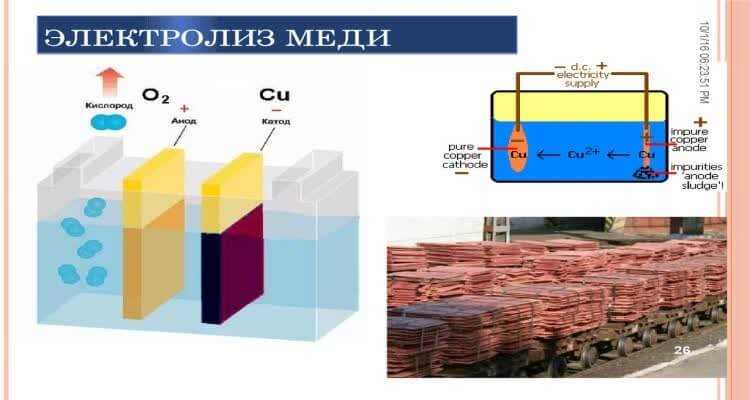
Рафинирование меди
В § 3.1 мы говорили о роли металлических проводников в современной электротехнике. Медь является лучшим материалом для изготовления проводников, но для этого она должна быть лишена каких бы то ни было примесей (см. § 2.4). Очищение меди от примесей называется рафинированием (очисткой) меди. Массивные куски (толстые листы) неочищенной меди, полученной при выплавке из руды, являются анодом, а тонкие пластинки из чистой меди — катодом. Процесс происходит в больших ваннах с водным раствором медного купороса. При электролизе медь анода растворяется; примеси, содержащие ценные и редкие металлы, выпадают на дно в виде осадка (шлама), а на катоде оседает чистая медь. Таким же образом производят рафинирование некоторых других металлов.
Получение алюминия
При помощи электролиза получают алюминий. Для этого подвергают электролизу не растворы солей этого металла, а его расплавленные оксиды.
В угольные тигли (рис. 3.9) насыпают глинозем (оксид алюминия Al2O3), полученный путем переработки бокситов — руд, содержащих алюминий. Тигель служит катодом. Анодом являются угольные стержни, вставленные в тигель. Сначала угольные стержни опускают до соединения с тиглем и пропускают сильный ток. Глинозем при прохождении тока нагревается и расплавляется. После этого угли поднимают, ток проходит через жидкость и производит электролиз. Расплавленный алюминий, выделяющийся при электролизе, опускается на дно тигля (катод), откуда его через особое отверстие выпускают в формы для отливки.
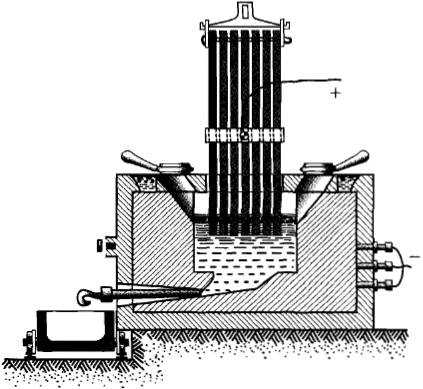
Рис. 3.9
Описанный способ получения алюминия сделал его дешевым и наряду с железом самым распространенным в технике и быту металлом.
Путем электролиза расплавленных солей в настоящее время получают также натрий, калий, магний, кальций и другие металлы.
|
Электролиз используется для гальваностегии, гальвано-пласт,ики, рафинирования меди, получения алюминия и др. |
Теоретическая часть
Электролиз – совокупность окислительно-восстановительных реакций, протекающих под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне. Электролиз проводят в особых приборах – электролизерах. Это сосуд с раствором или расплавом электролита и опущенными в него электродами из металла или графита. К электродам прикладывают разность потенциалов от внешнего источника постоянного тока. Катод отдает электроны частицам вещества в электролите и восстанавливает их. Анод отбирает электроны от частиц в электролите, окисляя их.
Электролиз расплавов оснований.
При электролизе процессы окисления и восстановления протекают на различных электродах – аноде и катоде. Анод – это электрод, на котором происходит процесс окисления. При электролизе анод заряжен положительно. Катод – это электрод, на котором происходит процесс восстановления. При электролизе катод заряжен отрицательно. На окислительно-восстановительные процессы, протекающие при электролизе, влияют различные факторы:
- Природа электролита и растворителя;
- Материал электродов;
- Режим электролиза (напряжение, сила тока, температура).
Будет интересно Все о законе Ома: простыми словами с примерами для «чайников»
Различают 2 типа электролиза: электролиз расплава и электролиз растворов электролитов. Электролиз расплавов оксидов На катоде идет восстановление катионов металла: Men++ nē = Me0 , т.е. на катоде выделяется металл. На аноде окисляется кислород: O –2 –2ē = O2 Например, электролиз расплава оксида калия: 2K2O = 4K + O2 При изучении алюминия, способов получения металлов, надо знать электролиз оксида алюминия. Металлический алюминий получают электролизом раствора глинозема Al2O3 в расплавленном криолите Na2AlF6 при 960–970°С. Электролиз Al2O3 можно представить следующей схемой: в расплаве оксид алюминия диссоциирует: Al2O3= Al3++ AlO3 3– , на катоде восстанавливаются ионы Al3+ : Al3++3ē Al0 , на аноде окисляются ионы AlO3 3– : 4AlO3 3– – 12ē 2Al2O3 + 3O2. Суммарное уравнение процесса: 2Al2O3 4Al + 3O2. Жидкий алюминий собирается на дне электролизера.
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл: Men+ +nē = Me0 На аноде будет окисляться кислород в составе гидроксид-группы: 4OH− −4ē =2H2O + O2 Электролиз расплавов солей 1. Электролиз расплава бескислородной соли: На катоде всегда восстанавливается металл: Men + nē = Me0 На аноде окисляется бескислородный анион: A n– – nē = A0 Например: Электролиз расплава NaCl: 2NaCl = 2Na + Cl2 2.Электролиз расплава кислородсодержащей соли (элемент аниона находится не в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде будет окисляться элемент аниона: SO3 2– – 2ē = SO3 0 Например, электролиз расплава сульфита натрия: Na2SO3 = 2Na + SO3 Сера S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 (SO3). 3.
Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде: т.к
элемент уже в высшей степени окисления, то окисляться будет кислород, например: 2CO3 –2 – 4ē = 2CO2 + O2 Например, электролиз расплава карбоната натрия: 2Na2CO3 = 4Na + 2CO2+ O2 Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока. Электролиз растворов На катоде могут протекать следующие реакции восстановления
Электролиз растворов На катоде могут протекать следующие реакции восстановления.
Электролиз расплавов оснований.

Как работает электролиз.
Лабораторная работа №4.
1. Электролиз водного раствора иодида калия.
2KJ+2H2O электролиз J2+2H2+2KOH
Процесс на аноде.
А(+): 2J—2e-→J2
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
В результате электролиза наблюдаем:
При добавлении фенолфталеина в околокатодное пространство раствор становится малинового цвета, так как при восстановлении молекул воды образуются ионы ОН-, которые создают щелочную среду.
При добавлении раствора крахмала в околоанодное простанство наблюдаем появление синего окрашивания, которое является качественной реакцией на молекулярный йод, который образуется при окислении ионов J-.
2. Электролиз водного раствора сульфата натрия.
- Na2SO4+2H2O электролиз Na2SO4+2H2+O2↑
- 2H2O электролиз 2H2+O2↑
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
При добавлении раствора универсального индикатора в околокатодное пространство наблюдаем синее окрашивание, так как при восстановлении молекул воды образуются ОН- ионы, которые дают щелочную среду.
При добавлении раствора универсального индикатора в околоанодное пространство наблюдаем красное окрашивание, так как при окислении молекул воды образуются H+ ионы, кторые дают кислую среду.
Сульфат натрия не принимает участия в электролизе. Протекает только электролиз воды.
3. Электролиз водного раствора сульфата меди (II).
2CuSO4+2H2Oэлектролиз 2Cu+O2+2H2SO4
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): Cu2++2е-→Сu0
При электролизе раствора сульфата меди (II) на катоде наблюдаем выделение осадка красной меди.
В околоанодном пространстве выделяются пузырьки кислорода.
Вывод по проведенной работе:
Электролиз -окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через систему, включающую электролит.
Электролиз растворов осложняется участием в электродных процессах ионов Н⁺ и ОН⁻. Кроме того, молекулы воды сами могут подвергаться электродному окислению или восстановлению.
Катодные процессы в водных растворах при электролизе зависят от природы катиона.
Процессы, происходящие на катоде зависят от окислительной способности катиона металла:
- Li, K, Ca, Na, Mg, Al Mn, Zn, Fe, Ni, Sn, Pb H Cu, Hg, Ag, Pt, Au
- Меn⁺не восстанавливается (остаётся в растворе)
- 2 Н₂О+ 2ē = Н₂↑+2 ОН⁻ Меn⁺ + nē = Me°
- 2 H₂O + 2ē = H₂↑ + 2 OH⁻ Men⁺ + nē = Me°
Анодные процессы в водных растворах зависят от материала анода и природы аниона.
Процессы, происходящие на аноде
Безкислородные кислотные остатки
Кислородсодержащие кислотные остатки
- J⁻, Br⁻, S²⁻, Cl⁻ Окисление Аm⁻ (кроме F⁻)
- Аm⁻ – m ē = A° OH⁻, SO₄²⁻, NO₃⁻, F⁻
В щелочной среде:
- 4 ОН⁻ – 4 ē = О₂↑ + 2 Н₂О
- в кислой и нейтральной среде: 2 Н₂О – 4 ē = О₂↑ + 4 Н⁺
(Влияние материала анода не рассматриваем, так как в лабораторной работе влияние материала анода на протекание электролиза не рассматривается).
8. Приведите формулировку законов Фарадея? Каковы их математические выражения? Что называют числом Фарадея? Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе растворов CdCl2 и CdSO4.
Ответ:
Течение первичных анодных и катодных реакций во время протекания электролиза подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
- m = kQ, но Q =It (1)
- где I – сила тока, А; t – время пропускание тока, с.
- m = kIt (2)
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
Подставив последнее уравнение в (2), получим формулу, объединяющую оба закона Фарадея. (3)
Соотношение (3) используют в расчетах процессов при электролизе.
Электролиз водного раствора хлорида кадмия (II):
- CdCl2Cd2++2Cl-
- K(-):Cd2+, H2O А(+): Cl-, H2O
- Cd2++2e-→Cd 2Cl—2e-→Cl2
Суммарное уравнение электролиза:
CdCl2→Сd+Cl2
Электролиз водного раствора сульфата кадмия (II):
- CdSO4→ Cd2++SO42-
- K(-):Cd2+, H2O А(+):SO42-, H2O
- Cd2++2e-→Cd 2H2O-4e-→O2+4H+
Суммарное уравнение электролиза:
2CdSO4+2 H2O→2Cd+O2+2H2SO4
История
Слово «электролиз» было введено Майклом Фарадеем в 19 веке по предложению преподобного Уильяма Уэвелла с использованием греческих слов ἤλεκτρον «янтарь», который с 17 века ассоциировался с электрическими явлениями , и λύσις означает «растворение». Тем не менее, электролиз как инструмент для изучения химических реакций и получения чистых элементов предшествует введению термина и формальному описанию Фарадеем.
В начале девятнадцатого века Уильям Николсон и Энтони Карлайл пытались продолжить эксперименты Вольты . Они прикрепили два провода по обе стороны от батареи Вольта, а другие концы поместили в трубку, наполненную водой. Они заметили, когда провода были соединены вместе, что каждая из них образовывала пузыри. Один тип — водород, другой — кислород.
В 1785 году голландский ученый по имени Мартинус Ван Марум создал электростатический генератор, который он использовал для восстановления олова, цинка и сурьмы из их солей с помощью процесса, позже известного как электролиз. Хотя он неосознанно производил электролиз, только в 1800 году Уильям Николсон и Энтони Карлайл обнаружили, как работает электролиз.
В 1791 году Луиджи Гальвани экспериментировал с лягушачьими лапками. Он утверждал, что размещение мышц животного между двумя разными металлическими листами привело к появлению электричества. В ответ на эти утверждения Алессандро Вольта провел собственные тесты. Это дало бы понимание идей Хэмфри Дэви по электролизу. Во время предварительных экспериментов Хамфри Дэви предположил, что когда два элемента соединяются вместе, образуя соединение, высвобождается электрическая энергия. Хамфри Дэви продолжил создавать таблицы разложения на основе своих предварительных экспериментов по электролизу. Таблицы разложения дадут представление об энергиях, необходимых для разложения определенных соединений.
В 1817 году Йохан Август Арфведсон определил, что в некоторых из его образцов есть еще один элемент, литий; однако он не мог изолировать компонент. Только в 1821 году Уильям Томас Бранде использовал электролиз, чтобы выделить его. Два года спустя он оптимизировал процесс, используя хлорид лития и хлорид калия с электролизом для получения лития и гидроксида лития.
В более поздние годы исследований Хэмфри Дэви его помощником стал Майкл Фарадей. Изучая процесс электролиза под руководством Хамфри Дэви, Майкл Фарадей открыл два закона электролиза .
Во времена Максвелла и Фарадея возникли опасения по поводу электроположительной и электроотрицательной активности.
В ноябре 1875 года Поль Эмиль Лекок де Буабодран открыл галлий, используя электролиз гидроксида галлия, с получением 3,4 мг галлия. В декабре он представил свое открытие галлия Академии наук в Париже.
26 июня 1886 года Фердинанд Фредерик Анри Муассан наконец почувствовал себя комфортно, проводя электролиз на безводном фтористом водороде для создания газообразного элемента с чистым фтором. Прежде чем использовать фтористый водород, Анри Муассан использовал фторидные соли при электролизе. Таким образом, 28 июня 1886 года он провел свой эксперимент перед Академией наук, чтобы продемонстрировать свое открытие нового элемента фтора. Ценой попыток найти элементарный фтор путем электролиза фторидных солей погибли многие химики, в том числе Полен Луайе и Жером Никлес.
В 1886 году Чарльз Мартин Холл из Америки и Поль Эру из Франции подали заявки на американские патенты, Эру подал свою в мае, а Холл — в июле. Холл смог получить свой патент, доказав в письмах своему брату и семье свидетельства того, что его метод был открыт до того, как был подан французский патент. Это стало известно как процесс Холла-Эру, который принес пользу многим отраслям промышленности, потому что цена на алюминий упала с четырех долларов до тридцати центов за фунт.
Лента новостей
- 1785 г. — электростатический генератор Мартинуса ван Марума был использован для восстановления олова , цинка и сурьмы из их солей с помощью электролиза.
- 1800 — Уильям Николсон и Энтони Карлайл (а также Иоганн Риттер ) разложили воду на водород и кислород .
- 1808 — Калий (1807), натрий (1807), барий , кальций и магний были открыты с помощью электролиза.
- 1821 — Литий был открыт английским химиком Уильямом Томасом Бранде , который получил его электролизом оксида лития.
- 1834 г. — Майкл Фарадей опубликовал свои два закона электролиза , дал им математическое объяснение и ввел такие термины, как электрод, электролит, анод, катод, анион и катион.
- 1875 — Поль Эмиль Лекок де Буабодран открыл галлий с помощью электролиза.
- 1886 — Анри Муассан открыл фтор с помощью электролиза.
- 1886 — Разработан процесс Холла-Эру для производства алюминия.
- 1890 — Разработан процесс Кастнера – Келлнера для производства гидроксида натрия .
Электролиз в промышленности
Принцип разделения веществ с помощью электричества не сложен и хорошо изучен, поэтому много где применяется. В результате разложения получаются различные химических вещества (металлы, щелочи, газы) в чистом виде, производится синтез органических частиц и неорганического материала, очистка сточных вод, разряжаются аккумуляторы, защищаются от коррозии и других негативных воздействий поверхности техники, инструментов и предметов быта.
Применение электролиза в технике, благодаря способности катода осаждать на себе молекулы химических элементов, позволяет создавать прочные бесшовные трубы, надежное защитное покрытие для металлических поверхностей, ювелирные украшения, точные слепки со сложных форм.
Добыча металлов
Электролиз расплавов эффективно используется при выделении из руды или солей активных металлов вроде алюминия, калия, бериллия или натрия.
В емкости, где проходит электролиз, катодом является дно, покрытое слоем углерода, а анодом – инертный углеродный стержень. В результате этой реакции продукт электролиза – чистый алюминий – скапливается на дне и сливается через специальные отверстия.
Электрометаллургия
Добыча металлов в электрометаллургии производится двумя видами процессов – электротермическими и электрохимическими. В первом случае выделение из руд и концентратов чистого вещества или образования сплава достигается за счет использования электричества как источника тепловой энергии. Во втором случае производство металла основывается на принципах электрохимического взаимодействия веществ.
Процесс рафинирование – это очистка меди
Чтобы получить очень чистую, рафинированную медь, в качестве электродов используются стержни или пластины из уже очищенного и с примесями металла и электролита – раствора сульфата меди.
Молекулы меди осаждаются на чистом катоде, а примеси выпадают на дно емкости в виде осадка. Таким же способом очищают золото, серебро и другие цветные металлы.
Гальванопластика
С помощью нанесения на исходный предмет равномерного металлического слоя возможно создать неограниченное число его копий. Для этого с оригинала снимается слепок и покрывается слоем электропроводящего вещества. Таким образом делаются слепки со сложных поверхностей, украшения и многого другого.

Гальванополировка
Если он заряжен положительно, то в процессе электролиза быстрее всего теряет выступающие электроны и таким способом становится более гладким, то есть полируется.
Анодирование
Защитное покрытие поверхности металла в этом случае выполняется за счет неметаллических соединений и серной кислоты.
Сфера применения технологии остаточно широка, ее принципы давно использовались даже в домашних условиях
Но очень важно тщательно соблюдать технику безопасности

Гальваническое покрытие
Электролизом можно нанести тонкий равномерный слой металла на поверхность предметов с целью сделать ее менее активной, защитить от негативных влияний, украсить, повысить или понизить электропроводимость.
В зависимости от дальнейшего предназначения гальванизируемого предмета его таким способом покрывают цветными и драгоценными металлами.































