История открытия
Закон Фарадея в электродинамике был открыт двумя ученными: Майклом Фарадеем и Джозефом Генри, но Фарадей опубликовал результаты своих работ раньше – в 1831 году.
В своих демонстрационных экспериментах в августе 1831 г. он использовал железный тор, на противоположные концы которого был намотан провод (по одному проводу на стороны). На концы одного первого провода он подал питание от гальванической батареи, а на выводы второго подключил гальванометр. Конструкция была похожа на современный трансформатор. Периодически включая и выключая напряжение на первом проводе, он наблюдал всплески на гальванометре.
Гальванометр — это высокочувствительный прибор для измерения силы токов малой величины.
Таким образом было изображено влияние магнитного поля, образовавшегося в результате протекания тока в первом проводе, на состояние второго проводника. Это воздействие передавалось от первого ко второму через сердечник – металлический тор. В результате исследований было обнаружено и влияние постоянного магнита, который двигается в катушке, на её обмотку.
Тогда Фарадей объяснял явление электромагнитной индукции с точки зрения силовых линий. Еще одной была установка для генерирования постоянного тока: медный диск вращался вблизи магнита, а скользящий по нему провод был токосъёмником. Это изобретение так и называется — диск Фарадея.
Ученные того периода не признали идеи Фарадея, но Максвелл взял исследования для основы своей магнитной теории. В 1836 г. Майкл Фарадей установил соотношения для электрохимических процессов, которые назвали Законами электролиза Фарадея. Первый описывает соотношения выделенной на электроде массы вещества и протекающего тока, а второй соотношения массы вещества в растворе и выделенного на электроде, для определенного количества электричества.
Что такое электролиз
Ток, как известно, представляет собой упорядоченное движение зарядов. Он может протекать не только по проводам, но и через другие вещества. Для этого необходимо, чтобы вещество имело носители зарядов.
В качестве проводника может выступать жидкость, в которой происходят окислительно-восстановительные реакции. В ней имеется большое количество ионов. При пропускании через такой раствор электрического тока происходит оседание вещества на электродах. На практике этим можно воспользоваться, например, для получения металлов с высокой степенью чистоты.
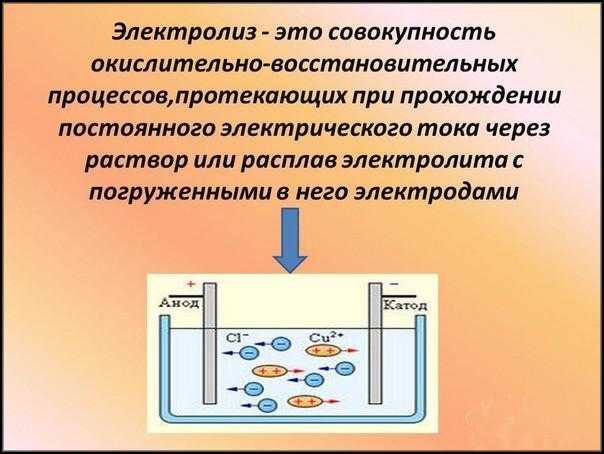
При электролизе на катоде будет проходить процесс восстановления, а на аноде — окисления. Продукты реакций иногда откладываются на электродах, а в некоторых случаях продолжают вступать во вторичные реакции.
Если раствор содержит соли металлов, то последний будет откладываться на катоде, а на аноде образуется газ. Это можно продемонстрировать на электролизе поваренной соли (NaCl). Чистый натрий будет оседать на катоде, а хлор — на аноде.
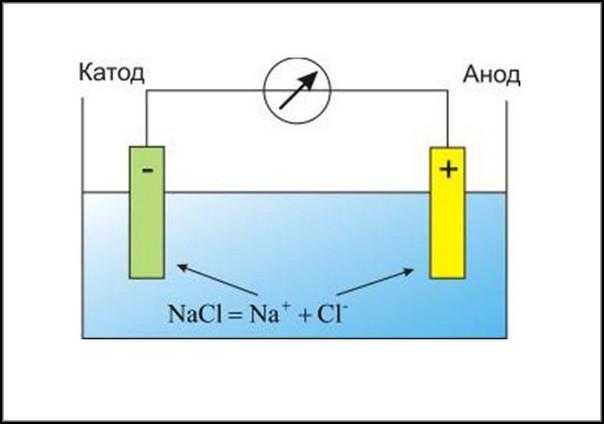
Растворы веществ, обеспечивающих высокое содержание ионов в жидкости, называются электролитами. Этот термин ввёл в употребление Фарадей. Согласно его определению, речь идёт о тех жидкостях, способных пропускать электроток.
Протекание электролитических реакций возможно при выполнении следующих условий:
В электролите не должно быть пространственной электрической однородности. В нем должна присутствовать объёмная неравномерность по уровню потенциала. Как пример можно привести ситуацию, когда в аккумуляторах происходит выработка электрического тока. Под его воздействием происходит неравномерное объёмное распределение зарядов в электролитах. Электроток обязательно должен быть постоянным.
Чтобы можно было говорить о прохождении тока, в растворе должны присутствовать носители электрозарядов
При этом важно, чтобы они могли свободно перемещаться под действием приложенного к ним электрического поля.
На практике к электролитам относят растворимые соли, а также кислоты и щёлочи. При прохождении электротока через металлический проводник в качестве носителей заряда выступают только электроны. В электролитах присутствует ещё одна их разновидность — ионы.
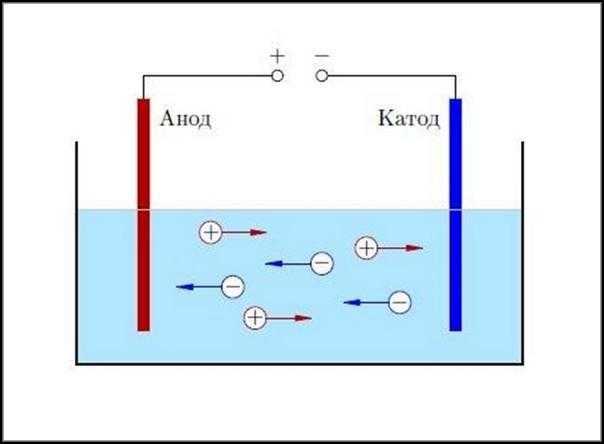
Обычно атомы водорода или металлов теряют электроны и становятся положительными ионами. Отрицательно заряженные ионы —это гидроксильные группы или кислотные молекулярные остатки. При воздействии электрополя на раствор ионы с отрицательным зарядом начинают притягиваться к аноду, а с положительным — к катоду. Электрический ток в жидкостях практически представляет собой одновременное перемещение носителей заряда противоположных знаков.
В результате отрицательные ионы отдают лишние электроны положительному электроду. Соответственно, положительные ионы восполняют недостающие электроны за счёт частиц, которые получают у отрицательного электрода. После восстановления электрической нейтральности эти вещества выделяются из раствора, осаждаясь или выделяясь в виде газа.
Здесь рассмотрена ситуация, когда происходит только одна электролитическая реакция. На практике получившиеся вещества могут участвовать в других реакциях. В результате процесс электролиза становится более сложным. Таких реакций может быть 2, 3 или больше.

ФИЗИКА
§ 3.5. Закон электролиза
При электролизе на электродах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенное время?
iiΔ
![]()
Масса иона, как мы уже знаем, равна
![]()
где М — молярная (или атомная) масса вещества, а NA — постоянная Авогадро, т. е. число ионов в одном моле. Число ионов, осевших на электроде,
![]()
где Δq = IΔt — заряд, протекший через раствор электролита за время Δt, q1. — заряд иона, который равен произведению элементарного заряда е на валентность n атома (или группы атомов), из которого образовался ион: q1 = еп.
При диссоциации молекул, состоящих из одновалентных атомов (n = 1), возникают однозарядные ионы. Например, при диссоциации молекулы бромида калия КВг возникают ионы К+ и Вг-, а при диссоциации молекулы медного купороса CuSO4 получаются два двухзарядных иона Сu+2 и SO-24, так как атом меди и кислотный остаток в данном соединении двухвалентны (n = 2).
Подставляя в формулу (3.5.1) выражения (3.5.2) и (3.5.3) и учитывая, что Δq = IΔt, а q1 = en, получим:
![]()
Закон Фарадея
Обозначим через k коэффициент пропорциональности между массой вещества m и зарядом Δq = lΔt в формуле (3.5.4):
![]()
Тогда формула (3.5.4) примет вид:
![]()
Следовательно, масса вещества, выделившегося на каждом из электродов, прямо пропорциональна силе тока и времени прохождения тока через раствор электролита.
Это утверждение, полученное нами теоретически, впервые было установлено в 1836 г. экспериментально М. Фарадеем и носит название закона электролиза Фарадея.
Коэффициент k в формуле (3.5.6) называют электрохимическим эквивалентом вещества и выражают в килограммах на кулон (кг/Кл). Из формулы (3.5.6) видно, что электрохимический эквивалент k численно равен массе вещества, выделившегося на электроде, при переносе ионами через раствор электролита заряда, равного 1 Кл.
Электрохимический эквивалент имеет простой физический смысл. Так как = mi и en = g1, то, согласно выражению (3.5.5),
![]()
т. е. электрохимический эквивалент данного вещества равен отношению массы иона этого вещества к его заряду.
Из формулы (3.5.5) следует также, что электрохимические эквиваленты веществ прямо пропорциональны молярным массам и обратно пропорциональны валентностям этих веществ.
При этом надо иметь в виду, что некоторые химические элементы в разных соединениях могут обладать различной валентностью. Так, например, медь одновалентна в соединениях CuCl, Cu2O и еще в некоторых других соединениях и двухвалентна в СuО, CuSO4 и еще в некоторых соединениях. В первом случае, когда медь одновалентна, ее электрохимический эквивалент равен 6,6 • 10-7 кг/Кл, а для двухвалентной меди электрохимический эквивалент в два раза меньше — он равен 3,3 • 10-7 кг/Кл.
Постоянная Фарадея
Произведение элементарного заряда (заряда электрона) e на постоянную Авогадро NA носит название постоянной Фарадея: F = eNA. Введя постоянную Фарадея в формулу (3.5.4), для массы вещества, выделившегося при электролизе на электроде, получим:
![]()
Согласно этой формуле постоянная Фарадея F численно равна заряду, который надо пропустить через раствор электролита, чтобы выделить на электроде один моль одновалентного вещества. Постоянная Фарадея, найденная из опыта, равна F = 9,65 • 104 Кл/моль. Для выделения на электроде одного моля n-валентного вещества через раствор электролита необходимо пропустить заряд, численно равный произведению nF.
Определение заряда электрона
Зная постоянную Авогадро NA и постоянную Фарадея F, можно найти модуль заряда одновалентного иона, т. е. заряд электрона:
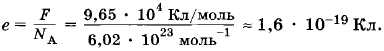
Любой двухвалентный ион переносит заряд в два раза больший, трехвалентный — в три раза больший и т. д. Но никогда не бывает, чтобы один ион переносил заряд, содержащий дробную часть заряда одновалентного иона.
Этот вывод, полученный из закона Фарадея, впервые в истории физики привел к мысли о том, что заряд одновалентного иона (e = 1,6 * 10-19 Кл) представляет собой наименьший (элементарный) заряд, существующий в природе. Любой электрический заряд состоит из целого числа элементарных зарядов.
Вывод о существовании в природе элементарного электрического заряда был сделан Гельмгольцем в конце прошлого века (1881), когда в науке еще не существовало представления об электроне. Значение элементарного заряда, вычисленное на основании закона электролиза, совпадает со значением заряда электрона, которое в дальнейшем было получено при исследовании других явлений.
|
Произведение силы тока на время определяет массу вещества, выделяемого при электролизе. Закон электролиза позволяет найти значение элементарного электрического заряда. |
Законы Майкла Фарадея

В результате проведения многих исследований в 1834 году английский физикохимик Майкл Фарадей (в его честь названа единица измерения электрической емкости — фарада) вывел два закона, которые способны количественно описать процесс электролиза. Хотя сам факт разложения соединений под действием проходящего электричества через их растворы был открыт задолго до Фарадея. В 1800 году другой английский ученый Уильям Николсон установил экспериментально этот факт.
Заслуги Фарадея в исследовании электролиза огромны. Он ввел в физикохимию основные термины, которые до сих пор используются для описания этого процесса. Два закона ученого в современной формулировке представляются следующим образом:
Масса вещества, которая оседает на электроде в процессе электролиза, прямо пропорциональна количеству электричества, проходящему через рассматриваемый электрод. Под количеством электричества понимается заряд, который в системе СИ измеряется в кулонах.
Для постоянного количества электричества масса химического соединения, которая образуется в ходе электролиза на электроде, является прямо пропорциональной величиной эквиваленту этого вещества. Под эквивалентом полагается отношение молярной массы к количеству молей электронов, участвующих в реакции. Это число совпадает с валентностью элемента, например, для Al3+ оно равно 3, а для H+ составляет 1.
Математическая формула
Оба закона получены Фарадеем экспериментальным путем. Их словесные формулировки можно легко объединить и перевести на математический язык. Общее уравнение, которое удобно использовать при решении любых практических задач, принимает следующую форму:
m = (Q/F)*(M/z).
Здесь m — масса образующегося вещества на электроде, Q — заряд, прошедший через электрод в процессе реакции, F — коэффициент пропорциональности, который называют постоянной Фарадея, M — молярная масса вещества, участвующего в химической реакции, z — его валентность (безразмерное число).
Первый множитель этого уравнения математически отражает сформулированный первый закон Фарадея, соответственно, второй множитель является выражением пропорциональности массы вещества его эквиваленту (M/z).

Эту формулу можно преобразовать, если вспомнить из курса общей физики, что заряд вычисляется по формуле:
Q = I*t.
Здесь I — электрический ток в амперах, t — время его прохождения через электролит. Подставив это выражение в математический закон Фарадея, и преобразуя его, можно получить следующие формулы:
m = kIt = (I*t/F)*(M/z) ==>
n*z*F = I*t.
Значение постоянной F
Численное значение постоянной Фарадея составляет приблизительно 96500 Кл/моль. Физический смысл этой величины заключается в том, что она говорит, какое количество электричества необходимо пропустить через раствор, чтобы выделилось на электроде 1 моль одновалентного вещества.
Величина F тесно связана с постоянной Авогадро NA и с элементарным зарядом электрона e следующим выражением:
F = NA*e.
Эта формула в XIX веке была использована учеными для точного определения числа NA. Сам Фарадей определил постоянную, носящую его фамилию, благодаря изучению процесса электролиза серебряного раствора.
В настоящее время проводятся эксперименты с целью точного определения величины F (а значит, NA), чтобы ее использовать для переопределения единицы измерения массы — килограмма.
Пример решения задачи

Рассмотрим электролиз хлорида кальция в водном растворе. Химическая формула соединения CaCl2. В воде оно хорошо растворяется с образованием ионов Ca2+ и Cl-. Пусть через этот раствор пропустили постоянный ток 5 ампер в течение 2 часов. Необходимо определить массы газообразного хлора и твердого кальция, которые выделятся на аноде и катоде, соответственно.
Известные данные задачи позволяют без проведения промежуточных вычислений провести расчет по современной формуле Фарадея:
Для анода получается: 2*Cl- — 2*e = Cl2. m (Cl2) = (I*t/F)*(M/z) = (5*7200/96500)*(0,0355/1) = 13,2 грамма.
Для катода получается: Ca2+ + 2*e = Ca. m (Ca) = (I*t/F)*(M/z) = (5*7200/96500)*(0,040/2) = 7,5 грамма.
Для проведения расчетов использовались молярные массы химических элементов Ca и Cl из таблицы Д. И. Менделеева.
Таким образом, законы Майкла Фарадея являются универсальными для их практического применения к любым химическим веществам, которые участвуют в процессах электролиза. Они позволяют количественно выразить результаты реакций на электродах.
Предыдущая запись Закон сохранения массы веществ в химии — формулировка, значение и примеры уравнений
Следующая запись Уксусный альдегид — структурная формула, свойства и применение
Закон Фарадея
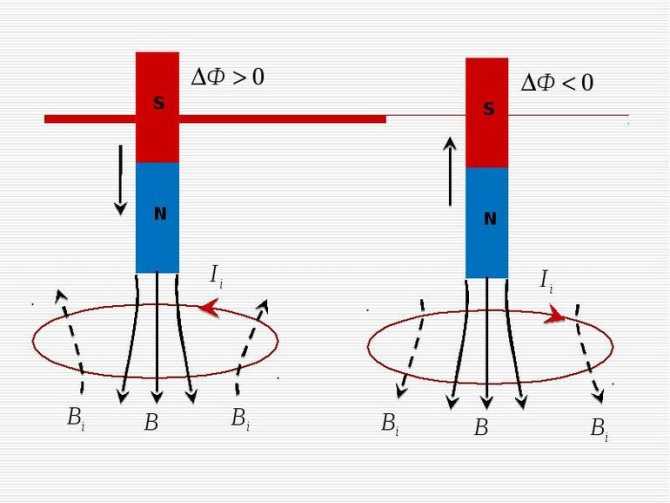
Явление электромагнитной индукции определяется возникновением электрического тока в замкнутом электропроводящем контуре при изменении магнитного потока через площадь этого контура.
Основной закон Фарадея заключается в том, что электродвижущая сила (ЭДС) прямо пропорциональна скорости изменения магнитного потока.
Формула закона электромагнитной индукции Фарадея выглядит следующим образом:
Рис. 2. Формула закона электромагнитной индукции
И если сама формула, исходя из вышесказанных объяснений не порождает вопросов, то знак «-» может вызвать сомнения. Оказывается существует правило Ленца – русского ученого, который проводил свои исследования, основываясь на постулатах Фарадея. По Ленцу знак «-» указывает на направление возникающей ЭДС, т.е. индукционный ток направлен так, что магнитный поток, который он создает, через площадь, ограниченную контуром, стремится препятствовать тому изменению потока, которое вызывает данный ток.
Основные понятия и законы электростатики
Закон Кулона:сила взаимодействия двух точечных неподвижных зарядов в вакууме прямо пропорциональна произведению модулей зарядов и обратно пропорциональна квадрату расстояния между ними:
Коэффициент пропорциональности в этом законе
В СИ коэффициент k записывается в виде
Потенциалом электрического поля называют отношение потенциальной энергии заряда в поле к этому заряду:
Проекция напряжённости электрического поля на какую-нибудь ось и потенциал связаны соотношением
Электроёмкостью тела называют величину отношения
Основные понятия и законы постоянного тока
Электрический ток — направленное движение электрических зарядов. В разных веществах носителями заряда выступают элементарные частицы разного знака. За положительное направление тока принято направление движения положительных зарядов. Количественно электрический ток характеризуют его силой. Это заряд, прошедший за единицу времени через поперечное сечение проводника:
Закон Ома для участка цепи имеет вид:
При параллельном соединении величина, обратная сопротивлению, равна сумме обратных сопротивлений:
где t — время, I — сила тока, U — разность потенциалов, q — прошедший заряд.Закон Джоуля-Ленца:
Основные понятия и законы магнитостатики
Характеристикой магнитного поля является магнитная индукция ➛B. Поскольку это вектор, то следует определить и направление этого вектора, и его модуль. Направление вектора магнитной индукции связано с ориентирующим действием магнитного поля на магнитную стрелку. За направление вектора магнитной индукции принимается направление от южного полюса S к северному N магнитной стрелки, свободно устанавливающейся в магнитном поле. Направление вектора магнитной индукции прямолинейного проводника с токам можно определить с помощью правила буравчика:если направление поступательного движения буравчика совпадает с направлением тока в проводнике, то направление вращения рукоятки буравчика совпадает с направлением вектора магнитной индукции. Модулем вектора магнитной индукции назовём отношение максимальной силы, действующей со стороны магнитного поля на участок проводника с током , к произведению силы тока на длину этого участка:
Основные понятия и законы электромагнитной индукции
Если замкнутый проводящий контур пронизывается меняющимся магнитным потоком, то в этом контуре возникает ЭДС и электрический ток. Эту ЭДС называют ЭДС электромагнитной индукции, а ток — индукционным. Явление их возникновения называют электромагнитной индукцией. ЭДС индукции можно подсчитать по основному закону электромагнитной индукции или по закону Фарадея:
Электромагнитные колебания и волны
Колебательным контуром называется электрическая цепь, состоящая из последовательно соединённых конденсатора с ёмкостью C и катушки с индуктивностью L (см. рис. 7).
Для свободных незатухающих колебаний в контуре циклическая частота определяется формулой
Период свободных колебаний в контуре определяется формулой Томсона:
Ток, текущий через катушку индуктивности, по фазе отстаёт от напряжения на π/2 или на четверть периода. Напряжение опережает ток на такой же фазовый угол.
Трансформатором называется устройство, предназначенное для преобразования переменных токов. Трансформатор состоит из замкнутого стального сердечника, на который надеты две катушки. Катушка, которая подключается к источнику переменного напряжения, называется первичной обмоткой, а катушка, которая подключается к потребителю, называется вторичной обмоткой. Отношение напряжения на первичной обмотке и вторичной обмотке трансформатора равно отношению числа витков в этих обмотках:
Понятие об электролитах
Прежде чем говорить об уравнении Фарадея, следует изучить свойства веществ, которые называют электролитами. Определение в химии для них дается простое: это любые соединения, раствор или расплав которых способен проводить электрический ток.
Для существования направленного движения зарядов внутри какой-либо субстанции необходимо выполнение двух обязательных условий:

Наличие пространственной разницы потенциалов электрического поля внутри субстанции. Эта разница может создаваться за счет электрических батарей, например, внутри аккумуляторов. Ток должен быть постоянным, а не переменным.
Существования свободных заряженных частиц. Если раствор или расплав являются нейтральными, то они образованы как положительными (катионы), так и отрицательными (анионы) частицами. Важным моментом является их способность свободно перемещаться внутри субстанции при приложении к ней некоторой разницы потенциалов.
Дело в том, что дистиллированная (абсолютно чистая) вода не проводит электричество, однако, уже незначительное количество примесей в ней делает ее хорошим проводником. Поскольку она также является замечательным растворителем благодаря полярному строению ее молекул, то часто применяется для приготовления растворов электролитов.
Применение явления
Значение закона Фарадея трудно недооценить, понимая, в каких целях он используется на практике. Вся электрическая промышленность построена на реализации открытия учёного. Одним из устройств использующего принцип возникновения ЭДС за счёт движения замкнутого проводника в магнитном поле является электрический генератор.
Его работа заключается в том, что если постоянный магнит перемещать относительно контура, то возникнет электродвижущая сила. Соответственно подключив проводник к нагрузке, можно получить ток. А это значит, что механическая энергия превратится в электрическую. При этом различают два принципиально разных механизма работы:
- Индуцированный — вращение магнита, вокруг не изменяющего своё положение проводника. В этом случае электрическое поле двигает заряды через проводник.
- Двигательный — магнит неподвижен, а проводник вращается. Появляется сила Лоренца, и магнитное поле толкает заряды.
Второе, но не менее важное устройство, электродвигатель. По сути, это генератор работающий «задом наперёд». На заряд действует магнитная сила, вращающая диск в обратном направлении, определить которое можно по правилу левой руки
Если будут потери небольшие, например, связанные с трением или выделением тепла, то подключённый диск будет вращаться с такой скоростью, чтобы отношение dF / dt сравнялось с разностью потенциалов вызывающего ток
На заряд действует магнитная сила, вращающая диск в обратном направлении, определить которое можно по правилу левой руки. Если будут потери небольшие, например, связанные с трением или выделением тепла, то подключённый диск будет вращаться с такой скоростью, чтобы отношение dF / dt сравнялось с разностью потенциалов вызывающего ток.
На использовании ЭДС построена работа и трансформатора. Проходящий по первичным виткам переменный электрический ток приводит к возникновению магнитного поля. Последнее и наводит во вторичной обмотке электродвижущую силу. Если только концы катушки подключить к нагрузке, то через неё сразу же потечёт ток.
Ионная проводимость
В металлах, как вы помните, имеется лишь один тип свободных зарядов — это свободные электроны. В электролитах ситуация иная: здесь возникают свободные заряды двух типов.
1. Положительные ионы, образовавшиеся из атомов металлов или водорода.
2. Отрицательные ионы — атомные или молекулярные кислотные остатки (например, или ), а также гидроксильная группа .
Второе отличие от металлов заключается в том, что носители свободных зарядов в электролите могут иметь заряд, равный по модулю как элементарному заряду , так и целому числу элементарных зарядов . Здесь — валентность атома или группы атомов; например, при растворении медного купороса имеем .
Если внешнего электрического поля нет, то свободные заряды электролита совершают лишь хаотическое тепловое движение наряду с окружающими молекулами. Но при наложении внешнего поля положительные и отрицательные ионы начинают упорядоченное движение.
Поместим в сосуд с электролитом два электрода; один из электродов присоединим к положительной клемме источника тока, а другой — к отрицательной (рис. 5). Когда речь идёт о прохождении тока через электролиты, положительный электрод называют анодом
, а отрицательный —катодом (Имеется народная мудрость для запоминания знаков анода и катода:Андрей — парень положительный, Катька — девка отрицательная ;-)).
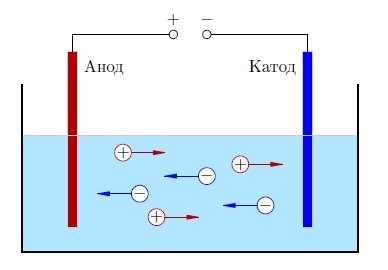
Рис. 5. Ионная проводимость электролита
В электрическом поле, возникшем между электродами, положительные ионы электролита устремляются к «минусу» катода, а отрицательные ионы — к «плюсу» анода. Таким образом, электрический ток в электролите образуется в результате встречного движения ионов: положительных — к катоду, отрицательных — к аноду
. Поэтому проводимость электролитов называетсяионной (в отличие от электронной проводимости металллов).
На положительном аноде имеется недостаток электронов. Отрицательные ионы, достигнув анода, отдают ему свои лишние электроны; эти электроны отправляются по цепи к «плюсу» источника.
Наоборот, на отрицательном катоде — избыток электронов. Положительные ионы, придя на катод, забирают у него электроны, и это количество ушедших электронов немедленно восполняется их доставкой на катод с «минуса» источника.
Таким образом, в той части цепи, которая состоит из источника тока и металлических проводников, возникает циркуляция электронов по маршруту «анод источник катод».
Цепь замыкается электролитом, где электрический ток обеспечивается двусторонним движением ионов.
ЭДС индукции в движущемся проводнике
При движении проводника длиной l
со скоростью \(\vec{\upsilon}\) в постоянном магнитном поле с вектором индукции \(\vec{B}\) в нем возникает ЭДС индукции \(~E_i = B \cdot \upsilon \cdot l \cdot \sin \alpha,\) где α – угол между направлением скорости \(\vec{\upsilon}\) проводника и вектором магнитной индукции \(\vec{B}\).
Причиной появления этой ЭДС является сила Лоренца, действующая на свободные заряды в движущемся проводнике. Поэтому направление индукционного тока в проводнике будет совпадать с направлением составляющей силы Лоренца на этот проводник.
С учетом этого можно сформулировать следующее для определения направления индукционного тока в движущемся проводнике (правило левой руки
):
нужно расположить левую руку так, чтобы вектор магнитной индукции \(\vec{B}\) входил в ладонь, четыре пальца совпадали с направлением скорости \(\vec{\upsilon}\)проводника, тогда отставленный на 90° большой палец укажет направление индукционного тока (рис. 5).
Рис. 5 Если проводник движется вдоль вектора магнитной индукции, то индукционного тока не будет (сила Лоренца равна нулю).
Николас Джозеф Каллан изобрел индукционную катушку
Ученые занимавшиеся изучением электричества подхватили идею ирландского священника Николас Джозеф Каллан (1799-1864) по изменению взаимно связанной индукции.
После посвящения в сан Каллан изучал физику в Римском университете, который окончил в 1826 году. По возвращении в Ирландию он был назначен профессором естественной философии (которую мы теперь называем физикой) в Колледже Святого Патрика в Мейнуте, недалеко от Дублина, где он основал свою лабораторию. В 1836 году Каллан построил первое устройство, способное эффективно эксплуатировать взаимную связь электричества. Его устройство состояло из двух катушек: с малым числом витков и большим из хорошо изолированных проводов, намотанных на железный сердечник. Резкое прекращение тока первой катушки вызывало высокое напряжение во второй (возможно, до нескольких десятков киловольт).
В 1854-1855 годах Каллан разработал электрохимические ячейки, которые собрал в большие батареи для питания электромагнитов. Каллан также построил ранние электрические двигатели и в 1853 году запатентовал гальванический процесс, направленный на предотвращение окисления железа. Тем не менее он не пренебрегал своим религиозным призванием, написав около 20 книг на подобные темы. Каллан построил свое устройство, потому что ему нужны были высокие напряжения в его экспериментах, трансформируя их из низкого напряжения, обеспечиваемого его батареями, но он не смог внедрить изобретения в широкую эксплуатацию.
Электрический ток в электролитах: задачи
Как решать задачи? Прочтите теорию (лучше несколько раз), вспомните памятку по решению физических задач, и вперед!
Задача на ток в электролитах №1
Условие
Проводящая сфера радиусом R = 5 см помещена в электролитическую ванну, наполненную раствором медного купороса. Насколько увеличится масса сферы, если отложение меди длится 30 минут, а электрический заряд, поступающий на каждый квадратный сантиметр поверхности сферы за 1 секунду, равен 0,01 Кл? Молярная масса меди М = 0,0635 кг/моль.
Решение
Площадь поверхности сферы вычислим по формуле:
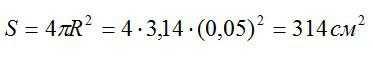
Теперь можем вычислить общий заряд, перенесенный ионами за 30 минут:
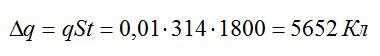
Рассчитаем массу выделившейся меди:
Ответ: 2 грамма.
Задача на ток в электролитах №2
Условие
Электролиз длился один час при силе тока, равной 5 А. Чему равна температура выделившегося атомарного водорода, если при давлении, равном 10^5 Па, его объём равен 1,5 л? Электрохимическии эквивалент водорода принять равным k=1*10^-8 кг/Кл.
Решение
Согласно первому закону Фарадея, масса выделившегося водорода определяется по формуле:
Также эту массу можно выразить из уравнения Клапейрона-Менделеева:
Приравняем два выражения для массы и найдем температуру:
Ответ: 100 К.
Задача на ток в электролитах №3
Условие
В процессе электролиза под действием тока плотностью 300 А/м^2 на электроде выделился слой меди толщиной 0,03 мм. В течении какого времени протекал электролиз?
Решение
Время электролиза определим из закона Фарадея:
Масса равна плотности, умноженной на объем. Объем меди можно вычислить, зная толщину слоя и плотность. Запишем:
Силу тока выразим через плотность тока и площадь:
Подставим выражения для массы и силы тока в выражение для времени, упростим его и вычислим:
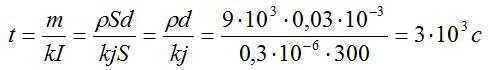
Ответ: 3000 секунд.
Плотность, как и значение электрохимического эквивалента, берутся из таблиц.
Задача на ток в электролитах №4
Условие
Зная электрохимический эквивалент серебра, определите электрохимический эквивалент золота.
Решение
Для решения данной задачи будем применять второй закон Фарадея. Валентость золота и серебра, а также молярные массы этих элементов возьмем из таблицы Менделеева. Запишем известные величины:
Теперь запишем второй закон Фарадея для золота и серебра:
Разделим одно уравнение на другое и выразим искомую величину:
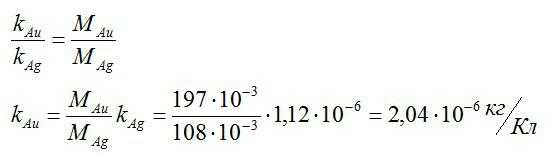
Ответ: 2,04*10^-6 кг/Кл.
Задача на ток в электролитах №5
Условие
Сколько электрической энергии понадобилось для получения серебра массой 0,2 кг, если КПД установки равен 0,8? Электролиз проводят при напряжении 20 В. Электрохимический эквивалент серебра возьмите из предыдущей задачи.
Решение
Энергия, которая идет только на электролиз, равна:
По закону Фарадея:
Полная затраченная энергия и энергия, затраченная только на электролиз, связаны выражением:
Отсюда:
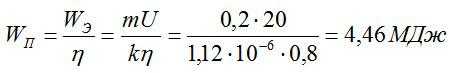
Ответ: 4,46 МДж.















![§ 76. законы фарадея для электролиза [1975 ковалев п.г., хлиян м.д. - физика (молекулярная физика, электродинамика)]](http://magazinzing.ru/wp-content/uploads/a/8/3/a83cb53e0417dd7ee1d517a272538358.jpeg)














